题目内容
4.化学与生产和生活、军事、科研产品紧密相关,下列说法不正确的是( )| A. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 | |
| B. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤的方法除去 | |
| C. | 家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| D. | 可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
分析 A.防治龋齿的有效成分是氟离子,当氟离子浓度相等时,防治龋齿的作用相同;
B.塑化剂为致癌性物质,且易溶于乙醇;
C.“84”消毒液与洁厕灵混合发生氧化还原反应生成有毒气体氯气;
D.浓盐酸与氨气接触冒白烟.
解答 解:A.防治龋齿的有效成分是氟离子,则在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的,故A正确;
B.塑化剂为致癌性物质,且易溶于乙醇,则不能饮用含塑化剂的白酒,且不能过滤除去塑化剂,故B错误;
C.“84”消毒液与洁厕灵混合发生氧化还原反应生成有毒气体氯气,则家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故,故C正确;
D.浓盐酸与氨气接触冒白烟,则可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应和性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
8.制备(NH4)2Fe(SO4)2•6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理.常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
15.向5.8g某饱和一元醛中加入足量的银氨溶液,在一定条件下充分反应后析出21.6g银,该醛是( )
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
19.室温下,下列溶液中粒子的物质的量浓度关系不正确的是( )
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
9.对下列实验的现象描述及其解释均正确的是( )
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
16.卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
回答下列问题:
(1)溴原子的价层电子排布图为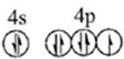 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合(HF)2形式存在,使氟化氢分子缔合的相互作用是氢键.碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl.
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
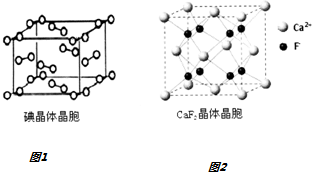
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.
回答下列问题:
(1)溴原子的价层电子排布图为
 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.

13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
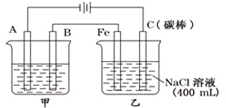 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池. 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题: