题目内容
1.某元素的最高价含氧酸的化学式为HnXO2n,则X元素的气态氢化物的化学式为( )| A. | XH8-3n | B. | HX | C. | XH2n | D. | HnX |
分析 化合物中元素的化合价代数和为零,据此计算X元素的化合价,再利用最高正化合价+|最低负化合价|=8,计算X元素在气态氢化物中的化合价.
解答 解:令X元素的化合价为a,化合物HnXO2n中元素的化合价代数和为零,则:1×n+a+2n×(-2)=0,解得:a=3n,
最高正化合价+|最低负化合价|=8,所以氢化物中X的负化合价为:最高正化合价-8=3n-8,则X元素的气态氢化物的化学式为:XH8-3n,
故选:A.
点评 本题考查化合物中元素化合价的计算,题目难度不大,清楚化合物中元素的化合价代数和为零是关键.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
11.下列指定反应的离子方程式一定错误的是( )
| A. | 苏打溶液与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| B. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-═NH3•H2O+BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
9.对下列实验的现象描述及其解释均正确的是( )
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
16.卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
回答下列问题:
(1)溴原子的价层电子排布图为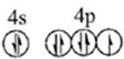 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合(HF)2形式存在,使氟化氢分子缔合的相互作用是氢键.碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:CsICl2$\frac{\underline{\;\;△\;\;}}{\;}$CsCl+ICl.
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
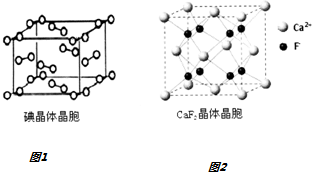
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.
回答下列问题:
(1)溴原子的价层电子排布图为
 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
(3)ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-具有相同空间构型和键合形式的物质化学式为(写出一个即可)Cl2O、OF2等.
(4)如图1为碘晶体胞结构,平均每个晶胞中有8个碘原子,碘晶体中碘分子的配位数为12.
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρg•cm-3,其晶胞如图2所示,两个最近Ca2+核间距离为anm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$×10-21a3ρNA.

13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
10.下列有关说法不正确的是( )
| A. | 酶是一种蛋白质 | B. | 蛋白质是有机高分子化合物 | ||
| C. | 蛋白质的基本组成单位为氨基酸 | D. | 氨基酸是羧酸,显酸性 |
14.下列说法中,不正确的是( )
| A. | “水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成 了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故 | |
| B. | 水的物理性质十分特殊.水的比热容较大,水结成冰后密度变小,水的熔沸点较高等特殊 性质是由于水分子间存在一种被称为氢键的特殊的分子间作用力 | |
| C. | 铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点 | |
| D. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在 游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材 料,最有潜力的应用是成为硅的替代品,用来生产未来的超级计算机 |
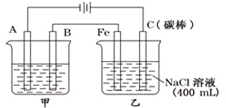 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池.