题目内容
3.把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )| A. | 3.5 mol/L | B. | 4.5 mol/L | C. | 7.0 mol/L | D. | 9.0 mol/L |
分析 把7.2g纯铁粉投入到40mL某HNO3溶液中,充分反应后剩余固体1.6g,说明生成硝酸亚铁,硝酸完全反应,反应中硝酸起氧化剂、酸性作用,起酸性作用的酸性生成硝酸亚铁,根据Fe元素守恒计算硝酸亚铁,起氧化剂作用的硝酸生成NO和NO2,根据N元素守恒可知n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2),最后根据c=$\frac{n}{V}$计算出原HNO3溶液的物质的量浓度.
解答 解:把7.2g纯铁粉投入到40mL某HNO3溶液中,充分反应后剩余固体1.6g,说明生成硝酸亚铁,硝酸完全反应,
参加反应的Fe的质量为:m(Fe)=7.2g-1.6g=5.6g,其物质的量为:n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,则生成硝酸亚铁的物质的量为:n[Fe(NO3)2]=n(Fe)=0.1mol,
反应中硝酸起氧化剂、酸性作用,起酸性作用的酸性生成硝酸亚铁,起氧化剂作用的硝酸生成NO和NO2,根据N元素守恒可知该硝酸溶液中含有硝酸的总物质的量为:n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2)=0.1mol×2+0.08mol=0.28mol,
所以原HNO3溶液的物质的量浓度为:c(HNO3)=$\frac{0.28mol}{0.04L}$=7.0mol/L,
故选C.
点评 本题考查氧化还原反应计算,题目难度中等,明确发生反应的实质为解答关键,注意从N元素守恒的角度解答该题,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
7.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3.用离子方程式解释现象Ⅰ:2Ag++SO32-=Ag2SO3↓.
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu2+和SO32-的理由是在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-.
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和Al(OH)3.
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一: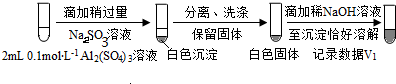
步骤二: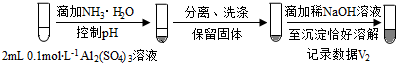 (按图形式呈现).
(按图形式呈现).
b.假设ii成立的实验证据是V1明显大于V2
(4)根据实验,亚硫酸盐的性质有溶解性、还原性、在水溶液中呈碱性.盐溶液间反应的多样性与两种盐溶液中阴、阳离子的性质和反应条件有关.
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu2+和SO32-的理由是在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-.
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和Al(OH)3.
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:

步骤二:
 (按图形式呈现).
(按图形式呈现).b.假设ii成立的实验证据是V1明显大于V2
(4)根据实验,亚硫酸盐的性质有溶解性、还原性、在水溶液中呈碱性.盐溶液间反应的多样性与两种盐溶液中阴、阳离子的性质和反应条件有关.
8.制备(NH4)2Fe(SO4)2•6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理.常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
11.下列指定反应的离子方程式一定错误的是( )
| A. | 苏打溶液与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| B. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-═NH3•H2O+BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
18.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
15.向5.8g某饱和一元醛中加入足量的银氨溶液,在一定条件下充分反应后析出21.6g银,该醛是( )
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池.