题目内容
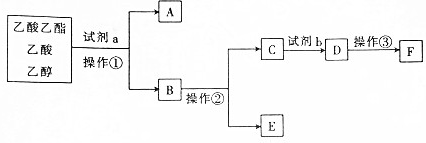
3.
下列说法错误的是( )
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
分析 由分离流程可知,试剂a为饱和碳酸钠,操作①为分液,得到A为乙酸乙酯,B中含乙醇、乙酸钠、碳酸钠,操作②为蒸馏,得到E为乙醇,C中含乙酸钠、碳酸钠,试剂b为硫酸,D中含硫酸钠、醋酸,操作③为蒸馏,F为乙酸,以此来解答.
解答 解:由分离流程可知,试剂a为饱和碳酸钠,操作①为分液,得到A为乙酸乙酯,B中含乙醇、乙酸钠、碳酸钠,操作②为蒸馏,得到E为乙醇,C中含乙酸钠、碳酸钠,试剂b为硫酸,D中含硫酸钠、醋酸,操作③为蒸馏,F为乙酸,
A.由上述分析可知,操作②是蒸馏,故A正确;
B.试剂a是饱和碳酸钠溶液,分离出乙酸乙酯,故B正确;
C.试剂b为硫酸,D中含醋酸,硫酸为强酸,醋酸为弱酸,则试剂b比同浓度的D溶液酸性强,故C正确;
D.A为乙酸乙酯,则E与F在浓硫酸加热的条件下可生成乙酸乙酯,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的混合物分离方法、物质的推断为解答的关键,侧重分析与实验能力的考查,注意有机物性质及应用,题目难度不大.

练习册系列答案
相关题目
13.下列实验能获得成功的是( )
| A. | 苯与浓溴水反应制取溴苯 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 1 mol•L-1 CuSO4溶液2mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 向稀苯酚中加浓溴水观察沉淀 |
14.由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:
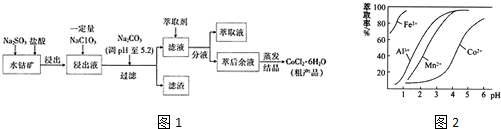
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O
(2)NaClO3在浸出液中发生反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为Fe(OH)3、Al(OH)3(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,其使用的最佳pH范围是B(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①粗产品含有可溶性氯化物,②晶体失去了部分结晶水.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O
(2)NaClO3在浸出液中发生反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为Fe(OH)3、Al(OH)3(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,其使用的最佳pH范围是B(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①粗产品含有可溶性氯化物,②晶体失去了部分结晶水.
8.下列有机物中,能发生消去反应、酯化反应的是( )
| A. |  | B. | CH3CH2CH2CH2Cl | ||
| C. |  | D. |  |
15.常温下,下列溶液中呈酸性的是( )
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
15.25℃时,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,二者恰好完全反应,则该温度下醋酸的电离平衡常数均为( )
| A. | 1014-a-2b | B. | 10a+b-14 | C. | 10a-2b | D. | 10a-2b+14 |