题目内容
18.取5.2g存放一段时间的Na2SO3粉末(部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为672mL,然后继续向溶液中缓慢加入0.1mol/LBa(OH)2溶液到100mL时,恰好沉淀完全且溶液呈中性,求:①Na2SO3的纯度为72.69%(写出计算过程,无计算过程不给分);
②盐酸物质的量浓度为0.8mol/L(写出计算过程,无计算过程不给分).
分析 ①Na2SO3能与盐酸反应,生成的672mL气体为SO2,根据S原子守恒Na2SO3的物质的量,进而计算样品中的Na2SO3纯度;
②加入氢氧化钡溶液恰好沉淀完全且溶液呈中性,此时溶液中溶质为NaCl,根据氯离子守恒n(HCl)=n(NaCl),根据钠离子守恒n(NaCl)=2n(Na2SO3)+2n(Na2SO4),结合①中计算可以计算硫酸钠的质量,进而计算硫酸钠的物质的量.
解答 解:①Na2SO3能与盐酸反应,生成的672mL气体为SO2,根据S原子守恒,n(Na2SO3)=n(SO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,样品中的Na2SO3的质量为0.03mol×126g/mol=3.78g,样品中的Na2SO3纯度为$\frac{3.78g}{5.2g}$×1005=72.69%,
故答案为:72.69%;
②样品中硫酸钠的质量为5.2g-3.78g=1.42g,硫酸钠的物质的量为$\frac{1.42g}{142g/mol}$=0.01mol,加入氢氧化钡溶液恰好沉淀完全且溶液呈中性,此时溶液中溶质为NaCl,根据氯离子守恒n(HCl)=n(NaCl),根据钠离子守恒n(NaCl)=2n(Na2SO3)+2n(Na2SO4),故n(HCl)=0.03mol×2+0.01mol×2=0.08mol,则盐酸的物质的量浓度为$\frac{0.08mol}{0.1L}$=0.8mol/L,
故答案为:0.8.
点评 本题考查混合物有关计算,关键是明确发生的反应,②中注意利用守恒法计算解答,侧重考查学生分析计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
9.对下列实验的现象描述及其解释均正确的是( )
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
13.滴定操作时,通过滴定管滴加到试样溶液中的溶液是( )
| A. | 一般溶液 | B. | 待测溶液 | ||
| C. | 有一定浓度的溶液 | D. | 标准溶液 |
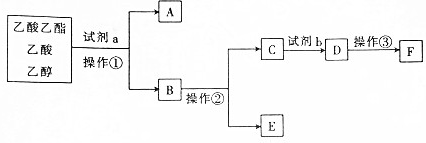
3.
下列说法错误的是( )

下列说法错误的是( )
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
10.下列有关说法不正确的是( )
| A. | 酶是一种蛋白质 | B. | 蛋白质是有机高分子化合物 | ||
| C. | 蛋白质的基本组成单位为氨基酸 | D. | 氨基酸是羧酸,显酸性 |
10.室温下,分别用0.1mol•L-1溶液进行下列实验,结论正确的是( )
| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
11.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |