题目内容
15.25℃时,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,二者恰好完全反应,则该温度下醋酸的电离平衡常数均为( )| A. | 1014-a-2b | B. | 10a+b-14 | C. | 10a-2b | D. | 10a-2b+14 |
分析 pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此分析;
解答 解:酸碱恰好中和,则酸的物质的量与碱的物质的量相等,所以醋酸的浓度为10a-14mol/L,而醋酸电离出的氢离子与醋酸根离子的浓度相等,都等于10-bmol/L,所以Ka=$\frac{1{0}^{-b}×1{0}^{-b}}{1{0}^{a-14}}$=1014-a-2b,故选A.
点评 本题考查了酸碱混合溶液的有关计算,难度不大,侧重于考查学生对知识的综合应用能力和数据处理能力.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
2.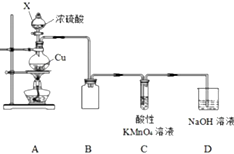 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
实验一:铜与浓硫酸反应
按如图装置进行实验(部分夹持装置略).
(1)仪器X的名称是分液漏斗,装置B的作用是防止倒吸;
(2)组装好仪器,检查装置气密性的操作是手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流;
(3)装置C中发生反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
实验二:探究产物成分
上述实验后发现烧瓶底部有灰色固体,兴趣小组同学设计实验进一步探究灰色固体的成分.
【查阅资料】
i.铜与浓硫酸反应可能有CuO、Cu2S、CuS等副产物生成.
ii.CuO、Cu2S和CuS均为黑色不溶于水的固体;Cu2S和CuS不溶于稀硫酸,在空气中充分燃烧,均转化为CuO和SO2.
【实验探究】
(4)请完成下表:
 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.实验一:铜与浓硫酸反应
按如图装置进行实验(部分夹持装置略).
(1)仪器X的名称是分液漏斗,装置B的作用是防止倒吸;
(2)组装好仪器,检查装置气密性的操作是手握烧瓶,若C、D导管中有气泡冒出,松开手,C、D中有液柱回流;
(3)装置C中发生反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
实验二:探究产物成分
上述实验后发现烧瓶底部有灰色固体,兴趣小组同学设计实验进一步探究灰色固体的成分.
【查阅资料】
i.铜与浓硫酸反应可能有CuO、Cu2S、CuS等副产物生成.
ii.CuO、Cu2S和CuS均为黑色不溶于水的固体;Cu2S和CuS不溶于稀硫酸,在空气中充分燃烧,均转化为CuO和SO2.
【实验探究】
(4)请完成下表:
| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
3.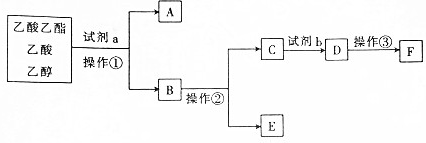
下列说法错误的是( )

下列说法错误的是( )
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
10.室温下,分别用0.1mol•L-1溶液进行下列实验,结论正确的是( )
| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
4.在短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 四种元素均可与氢元素形成 18电子分子 | |
| B. | X、Y、Z、W形成的单质最多有 6种 | |
| C. | 四种元素中,Z的最高价氧化物对应水化物酸性最强 | |
| D. | 四种元素的原子半径:rZ>rX>rY>rW |
5.下列说法中正确的是( )
| A. | 外围电子就是最外层电子 | |
| B. | 最外层电子数小于4的元素一定是金属元素 | |
| C. | 过渡元素的最外层电子数一般为1个或2个 | |
| D. | 如果某元素最外层电子数是1个或2个,次外层电子数为18个,此元素是副族元素 |