题目内容
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g).经4min后测知D的浓度为0.5mol?L-1,c(A):c(B)=3:5,C的平均反应速率是0.125mol?L-1?min-1,此时A的物质的量浓度为 ,B的平均反应速率为 ,x值是 .
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
,化学反应速率之比等化学计量数之比,结合方程式利用三段式进行解答,得出正确结论.
| △c |
| △t |
解答:
解:4 min内D的浓度变化量为0.5 mol?L-1,故A和B的浓度变化量分别为
×0.5 mol?L-1=0.75 mol?L-1和
×0.5 mol?L-1=0.25 mol?L-1,
设A、B的起始浓度为n,则
3A(g)+B(g)=xC(g)+2D(g)
起始浓度 n n 0 0
变化量 0.75 0.25 0.25x 0.5
4min后浓度 (n-0.75)(n-0.25)0.25x 0.5
c(A):c(B)=(n-0.75):(n-0.25)=3:5,n=1.5 mol?L-1,
c(A)=(n-0.75)mol?L-1=0.75 mol?L-1,
v(D)=
=0.125mol?L-1?min-1=v(C),故x=2,
v(D):v(B)=2:1,故v(B)=0.5v(D)=0.5×0.125mol?L-1?min-1=0.0625mol?L-1?min-1,
故答案为:0.75 mol?L-1;0.0625mol?L-1?min-1;2.
| 3 |
| 2 |
| 1 |
| 2 |
设A、B的起始浓度为n,则
3A(g)+B(g)=xC(g)+2D(g)
起始浓度 n n 0 0
变化量 0.75 0.25 0.25x 0.5
4min后浓度 (n-0.75)(n-0.25)0.25x 0.5
c(A):c(B)=(n-0.75):(n-0.25)=3:5,n=1.5 mol?L-1,
c(A)=(n-0.75)mol?L-1=0.75 mol?L-1,
v(D)=
| 0.5 |
| 4 |
v(D):v(B)=2:1,故v(B)=0.5v(D)=0.5×0.125mol?L-1?min-1=0.0625mol?L-1?min-1,
故答案为:0.75 mol?L-1;0.0625mol?L-1?min-1;2.
点评:本题考查化学反应速率的相关计算,难度中等,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①2C(焦炭)+O2(空气)=2CO;②Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是:( )
| A、CO过量 |
| B、CO与铁矿石接触不充分 |
| C、炼铁高炉的高度不够 |
| D、CO与Fe2O3的反应有一定限度 |
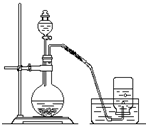 利用如图所示装置制取氧气并进行相关的实验探究.
利用如图所示装置制取氧气并进行相关的实验探究.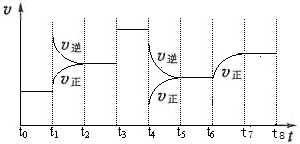
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.