题目内容
18.(1)请写出烷烃在足量的氧气中充分燃烧的化学方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O.有①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,试回答下列问题:
(2)相同状况下,等体积的上述气态烃,消耗O2的量最多的是丁烷.
(3)等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是甲烷.
(4)在120℃1.01×105Pa条件下,某气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃为甲烷.
(5)10mL某气态烃,在50mLO2中充分燃烧,得到液态水,以及体积为35mL的混合气(所有气体体积均在同温同压下测定),该气态烃是乙烷.
(6)
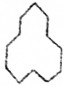 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
分析 (1)烷烃在足量的氧气中充分燃烧生成二氧化碳和水,配平确定化学计量数.
(2)相同状况下,等体积的气态烃,消耗O2的量取决于(x+$\frac{y}{4}$) 的值,(x+$\frac{y}{4}$) 越大消耗O2的量越多.
(3)等质量的烃,在充分燃烧时,消耗O2的量取决于H的质量分数ω(H),ω(H)越大消耗O2的量越多.
(4)反应前后气体的体积没有发生改变,则前后气体的化学计量数相等,根据烃足量的氧气中充分燃烧的通式计算.
(5)根据完全燃烧消耗O2的量,先判断是否完全燃烧,再根据方程式利用差量法计算;
(6)根据键线式的表示方法及环烷烃的命名原则对该有机物进行命名;根据该环烷烃的分子式计算出消耗的氧气的物质的量.
解答 解:(1)烷烃在足量的氧气中充分燃烧生成二氧化碳和水,化学方程式:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,
故答案为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O;
(2)①甲烷,分子式为CH4②乙烷,分子式为C2H6③丙烷,分子式为C3H8,④丁烷,分子式为C4H10,它们的(x+$\frac{y}{4}$)值分别为2、3.5、5、6.5,丁烷的(x+$\frac{y}{4}$)值最大,即消耗O2的量最多,故答案为:丁烷;
(3)①甲烷,分子式为CH4②C、H原子个数比为1:4,H的质量分数ω(H)最大,消耗O2的量最多,故答案为:甲烷;
(4)在120℃,1.01×105Pa条件下,生成的水为气态,
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),
所以 1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$
解得,y=4,即分子式中氢原子数目为4,
故答案为:甲烷;
(5)①甲烷,②乙烷,③丙烷,④丁烷4种烷烃中它们的(x+$\frac{y}{4}$)值分别为2、3.5、5、6.5,10ml完全燃烧需要的氧气的体积分别为20ml、35ml、50ml、65ml,
所以只有丁烷不能完全燃烧,
若完全燃烧,则混合气体是CO2、O2,设烃为CxHy,则
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),体积减小△V
1 1+(x+$\frac{y}{4}$)-x=1+$\frac{y}{4}$
10 (10+50-35)=25
所以10(1+$\frac{y}{4}$)=25,解得y=6,即1分子烃中H的原子个数是6,
氧气有剩余,所以10(x+$\frac{y}{4}$)<50,由于y=6,解得x<3.5,
所以气态烃为乙烷,
若不完全燃烧,10mL丁烷生成CO需要氧气为45ml,小于50ml,所以混合气体是CO2、CO,设烃为CxHy,根据C原子守恒,有10x=35,解得,x=3.5,碳原子数目为整数,不成立.
故答案为:乙烷;
(6) 为环戊烷,分子中含有12个C,所以其名称为环十二烷;该有机物中含有一个环,含有的氢原子被烷烃少2个H,所以环十二烷的分子式为C12H24,1molC12H24完全燃烧消耗氧气的物质的量为:(12+$\frac{24}{4}$)mol=18mol,
为环戊烷,分子中含有12个C,所以其名称为环十二烷;该有机物中含有一个环,含有的氢原子被烷烃少2个H,所以环十二烷的分子式为C12H24,1molC12H24完全燃烧消耗氧气的物质的量为:(12+$\frac{24}{4}$)mol=18mol,
故答案为:环十二烷;18.
点评 本题考查有机物计算,考查学生分析和解决问题的能力,难度中等,熟记结论,使用体积差的计算方法要注意.

| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
| A. | pH试纸 | B. | 紫色石蕊试液 | C. | Na2CO3固体 | D. | CuCl2溶液 |
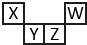 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
| A. | 原子半径:W>Z>Y>X | |
| B. | X、Y和Z三种元素形成的化合物中一定含有离子键和共价键 | |
| C. | 化合物YX3溶解于水中促进了水的电离 | |
| D. | Y的最高价氧化物对应的水化物一定有强氧化性 |
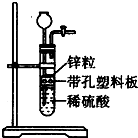 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )| A. | ①②③ | B. | ②④⑤ | C. | ②③④⑥ | D. | ②③⑥ |
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
| A. | BaCl2═Ba2++2Cl- | B. | Fe2(SO4)3═Fe23++(SO4)32- | ||
| C. | HNO3═H++NO3- | D. | Ba(OH)2═Ba2++2OH- |