题目内容
17.(1)在浓硝酸中放入铜片,开始时反应的化学方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式表示)3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面无明显现象,则发生了钝化;若铁棒表面会有紫红色的铜析出,则未发生反应.
(3)制取硫酸铜有两种方法:方法一:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+H2O,方法二:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是(至少答两点):无污染、节约硫酸.
分析 (1)Cu与浓硝酸反应生成二氧化氮和硝酸铜溶液,浓硝酸随反应的进行变为稀硝酸,则反应快结束时铜和稀硝酸反应生成NO;硝酸盐在酸性条件下具有硝酸的氧化性,则能继续与铜反应;
(2)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化镁保护膜阻止Fe与硫酸铜反应,否则发生反应,会有铜析出;
(3)根据硫酸用量及有无二氧化硫生成等分析解答.
解答 解:(1)因反应开始硝酸的浓度大,反应剧烈,反应生成硝酸铜溶液、二氧化氮和水,其反应方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,硝酸盐在酸性条件下具有硝酸的氧化性,则能与铜与氢离子、硝酸根离子继续反应生成NO,铜和稀硝酸反应生成NO,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部继续进行反应,若发生钝化,则氧化镁保护膜阻止Fe与硫酸铜反应,无明显现象,否则发生反应,会有紫红色的铜析出,
故答案为:无明显现象;有紫红色物质析出;
(3)方法一与方法二相比,硫酸的用量较少,没有二氧化硫生成、无污染,
故答案为:无污染、节约硫酸;
点评 本题主要考查氧化还原反应、电子转移、方程式的书写、元素化合物的性质等,主要是硝酸的性质和硝酸盐在酸性条件下的性质,明确铜与浓、稀硝酸反应的化学反应即可解答,难度中等,掌握元素化合物的性质是解题的关键,侧重于考查学生分析问题和解决问题的能力.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | ||||||
| 3 | D | E | F | G | H | I | ||
(2)B元素的最高正化合价是+4.
(3)D、E、F三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第VIA族,该元素的原子结构示意图是b(选填编号).
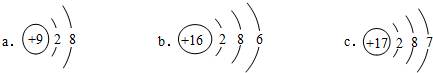
(5)化学键的断裂和形成都伴随着能量变化,那么1mol H2O→2mol H+1 mol O的变化过程要吸收(填“吸收”或“放出”)能量.
| A. | 己烷(己烯) 溴水 分液 | B. | 淀粉溶液(NaCl) 水 过滤 | ||
| C. | CH3CH2OH(CH3COOH) CaO 蒸馏 | D. | CO2(SO2) Na2CO3溶液 洗气 |
| A. | NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+2H2O | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | C2H6 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
| A. | r(Al)/r(Na) | B. | r(C)/r(Si) | C. | r(F?)/r(Mg2+) | D. | r(Fe2+)/r(Fe) |
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
 .
. .
.