题目内容
6.下列粒子半径之比大于1的是( )| A. | r(Al)/r(Na) | B. | r(C)/r(Si) | C. | r(F?)/r(Mg2+) | D. | r(Fe2+)/r(Fe) |
分析 A.同周期随原子序数增大原子半径减小;
B.同主族自上而下原子半径增大;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.阳离子半径小于相应的原子半径.
解答 解:A.同周期随原子序数增大原子半径减小,原子半径r(A)<r(Na),则$\frac{r(Al)}{r(Na)}$<1,故A不选;
B.同主族自上而下原子半径增大,则$\frac{r(C)}{r(Si)}$<1,故B不选;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故$\frac{r({F}^{-})}{r(M{g}^{2+})}$>1,故C选;
D.阳离子半径小于相应的原子半径,故$\frac{r(F{e}^{2+})}{r(Fe)}$<1,故D不选.
故选:C.
点评 本题考查微粒半径比较,掌握半径比较规律即可解答,注意从结构上理解影响微粒大小的因素.

练习册系列答案
相关题目
14.科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
| A. | 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 暖冰中水分子的各原子均满足8电子稳定结构 | |
| C. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
11.选用适当的试剂和方法除去下列物质中的杂质(括号内)填表:
| 混合物 | 除杂质的试剂 | 除杂质的方法 |
| 苯(苯酚) | NaOH溶液 | 分液 |
| 酒精(水) | 生石灰 | 蒸馏 |
| 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
18.CaF2的晶胞结构如图所示,在晶胞中,Ca2+的配位数为( )


| A. | 4 | B. | 6 | C. | 8 | D. | 12 |
15.下列排序正确的是( )
| A. | 沸点:PH3<NH3<H2O | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 酸性:H2CO3<HClO<HNO3 |
 和
和 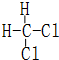 同一种物质.
同一种物质.