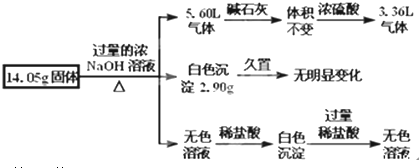
题目内容
15.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等.在相同温度下,发生2SO2+O2?2SO3并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持压强不变.若甲容器中SO2 的转化率为α,则乙容器中SO2 的转化率为( )| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
分析 先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积则乙的压强增大,平衡正向移动.
解答 解:先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积时,乙的压强增大,平衡正向移动.所以,若甲容器中SO2的转化率为α,则乙的SO2的转化率将大于甲的,即大于α.
故选B.
点评 本题考查了化学平衡的影响因素分析判断,恒温恒容、恒温恒压容器的变化特征,题目难度中等,掌握分析方法是关键.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
3.某含Na+的溶液中可能含有Al3+、NH4+、Fe3+、CO32-、I-、SO32-.取样,滴加足量氯水,有气泡产生;继续向溶液中加BaCl2溶液或淀粉均无现象.为确定该溶液的组成,还需进行的实验有( )
| A. | 取样,滴加硫氰化钾溶液 | |
| B. | 取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,逐滴滴入氢氧化钠溶液直至足量 | |
| D. | 取样,加足量盐酸加热,湿润的品红试纸检验气体 |
20.相同温度下用惰性电极电解下列物质的水溶液,一段时间后溶液酸碱性不变的是( )
| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | CuSO4 |
7.乙醇是一种重要的化工原料,在人们日常生活中有广泛应用.下列关于乙醇的说法不正确的是( )
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
 2SO4(s) D.CH3COONa溶液
2SO4(s) D.CH3COONa溶液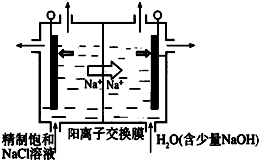 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺