题目内容
现有X、Y、Z、M四种元素均为短周期元素.有关信息如下表:
(1)X元素在周期表的位置是 ;
(2)1个Y单质分子中含 对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为 .
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为 ,用化学方程式表示X2M溶液在空气中的变质过程 .
| 原子或分子结构、单质或化合物相关信息 | |
| X | 含X元素的物质焰颜色反应为黄色 |
| Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z | Z元素原子易失去2个电子形成8电子结构的离子 |
| M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(2)1个Y单质分子中含
(3)Z能在CO2气体中燃烧,其化学反应方程式为
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M四种元素均为短周期元素,含X元素的物质焰色反应为黄色,则X为Na;Y单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得Y的单质,则Y为N元素;Z元素原子易失去2个电子形成8电子结构的离子,则Z为Mg;M元素原子的最外层电子数是K层电子数的3倍,最外层电子数为6,M与X处于同一周期,则M为硫元素,据此解答.
解答:
解:X、Y、Z、M四种元素均为短周期元素,含X元素的物质焰色反应为黄色,则X为Na;Y单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得Y的单质,则Y为N元素;Z元素原子易失去2个电子形成8电子结构的离子,则Z为Mg;M元素原子的最外层电子数是K层电子数的3倍,最外层电子数为6,M与X处于同一周期,则M为S元素,
(1)X为Na元素,在周期表中第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)Y为N元素,1个单质分子中含3个共用电子对,故答案为:3;
(3)Mg在CO2气体中燃烧生成MgO与C,其化学反应方程式为2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
(4)化合物Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,X2M2为Na2S2,此溶液显黄色,其电子式为: ,用化学方程式表示X2M溶液在空气中的变质过程为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
,用化学方程式表示X2M溶液在空气中的变质过程为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为: ;4Na2S+O2+2H2O═4NaOH+2Na2S2.
;4Na2S+O2+2H2O═4NaOH+2Na2S2.
(1)X为Na元素,在周期表中第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)Y为N元素,1个单质分子中含3个共用电子对,故答案为:3;
(3)Mg在CO2气体中燃烧生成MgO与C,其化学反应方程式为2Mg+CO2
| ||
| ||
(4)化合物Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,X2M2为Na2S2,此溶液显黄色,其电子式为:
 ,用化学方程式表示X2M溶液在空气中的变质过程为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
,用化学方程式表示X2M溶液在空气中的变质过程为:4Na2S+O2+2H2O═4NaOH+2Na2S2,故答案为:
 ;4Na2S+O2+2H2O═4NaOH+2Na2S2.
;4Na2S+O2+2H2O═4NaOH+2Na2S2.
点评:本题考查结构性质位置关系应用,难度不大,(4)中注意根据题目信息书写其电子式.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列实验能达到目的是( )
A、 测定乙醇结构式 |
B、 测定硫酸浓度 |
C、 合成并检验氨 |
D、 分离并回收硝基苯中的苯 |
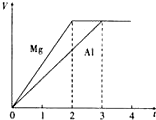 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |
元素及其化合物丰富了物质世界,下列说法正确的是( )
| A、常温下把Cu放入冷的浓H2SO4中无明显现象,是因为Cu在冷的浓H2SO4中会钝化 |
| B、NaOH溶液和A1Cl3溶液相互滴加的现象不同 |
| C、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D、Al与热水反应困难,故活泼性不及Al的金属在任何条件下均不能与H2O发生反应 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Cu2+、Ba2+、C1-、SO42- |
| B、K+、Na+、OH-、C1- |
| C、Na+、H+、SO42-、OH- |
| D、H+、Na+、Cl-、CO32- |
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
| A、甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍 |
| B、中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙) |
| C、物质的量浓度c(甲)>10c(乙) |
| D、甲中的c(OH-)为乙中的c(OH-)的10倍 |
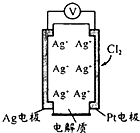 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
| A、电子经外电路流向Pt电极 |
| B、电池工作时,电解质中Ag+数目减少 |
| C、正极反应:C12+2e-+2Ag+=2AgCl |
| D、空气中c(C12)越大,Ag极消耗速率越快 |
0.2L 1mol/LFeCl3与0.3L 1mol/LMgCl2两溶液中,Cl-的物质的量浓度之比为( )
| A、3:2 | B、1:1 |
| C、2:3 | D、1:3 |