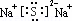题目内容
15.在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应A(g)+B(g)?xC(g)+D(g)△H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:(1)x值等于1.
(2)A的转化率为33.3%.
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率不变(填“增大”、“减小”或“不变”).
(4)该反应的平衡常数的表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,450℃时平衡常数大于500℃时平衡常数(填“大于”、“小于”或“等于”).
(5)相同温度下,若起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,反应达到平衡前,反应速率v正>v逆(填“>”或“<”),达到平衡时D的浓度为0.15mol/L.
分析 (1)2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2 mol•L-1•min-1,v(C)=$\frac{0.4mol/L}{2}$=0.2 mol•L-1•min-1,结合速率之比等于化学计量数之比确定x;
(2)A(g)+B(g)?C(g)+D(g)
开始2.4 1.2 0 0
转化 0.8 0.8 0.8 0.8
结合转化率=$\frac{转化的量}{开始的量}$×100%计算;
(3)容积为2L的某密闭容器,物质的量与压强成正比,压强增大,平衡不移动;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比;△H<0,升高温度,平衡逆向移动;
(5)起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,Qc=$\frac{0.1mol/L×0.1mol/L}{0.2mol/L×0.2mol/L}$=0.25,与K比较判断反应的方向,并计算平衡时D的浓度.
解答 解:(1)2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2 mol•L-1•min-1,v(C)=$\frac{0.4mol/L}{2}$=0.2 mol•L-1•min-1,由速率之比等于化学计量数之比可知x=1,故答案为:1;
(2)A(g)+B(g)?C(g)+D(g)
开始2.4 1.2 0 0
转化 0.8 0.8 0.8 0.8
平衡 1.6 0.4 0.8 0.8
A的转化率为$\frac{0.8}{2.4}$×100%=33.3%,K=$\frac{0.4×0.4}{0.8×0.2}$=1,
故答案为:33.3%;
(3)容积为2L的某密闭容器,物质的量与压强成正比,压强增大,平衡不移动,可知再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率不变,
故答案为:不变;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{c(C)c(D)}{c(A)c(B)}$;△H<0,升高温度,平衡逆向移动,K减小,则450℃时平衡常数大于500℃时平衡常数,
故答案为:$\frac{c(C)c(D)}{c(A)c(B)}$;大于;
(5)起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,Qc=$\frac{0.1mol/L×0.1mol/L}{0.2mol/L×0.2mol/L}$=0.25<K=1,则平衡正向移动,反应速率v正>v逆,则
A(g)+B(g)?C(g)+D(g)
开始0.4 0.4 0.2 0.2
转化 x x x x
平衡 0.4-x 0.4-x 0.2+x 0.2+x
则$\frac{(0.2+x)^{2}}{(0.4-x)^{2}}$=1,解得x=0.1mol,
达到平衡时D的浓度为$\frac{0.2mol+0.1mol}{2L}$=0.15mol/L,
故答案为:>;0.15mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、反应进行的方向判断等为解答的关键,侧重分析与计算能力的考查,注意x的确定方法,题目难度不大.

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案CO ( g )+2H2( g )?CH3OH ( l )△H
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1mol CO ( g )和2molH2( g )生成CH3OH( g ),H2的平衡转
化率随温度(T)、压强(P)的变化如图1所示.
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c(CO)的变化曲线.

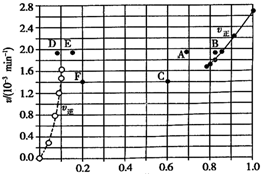 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
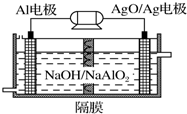 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.