题目内容
配制0.1mol?L-1的硫酸500mL,最适宜的一组仪器是( )
| A、托盘天平、烧杯、容量瓶、玻璃棒 |
| B、烧杯、玻璃棒、胶头滴管、量筒 |
| C、烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D、烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:根据所配溶液体积选择容量瓶规格,根据配制溶液的实验操作过程选择其它仪器.
解答:
解:配制0.1mol?L-1的硫酸500mL,应选择500ml容量瓶.
配制500ml0.1mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所需仪器有:烧杯、容量瓶(500mL)、玻璃棒、胶头滴管、量筒.
故选D.
配制500ml0.1mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所需仪器有:烧杯、容量瓶(500mL)、玻璃棒、胶头滴管、量筒.
故选D.
点评:本题以配制溶液仪器选择为载体,考查了一定物质的量浓度溶液的配制操作,难度不大,注意由所需浓硫酸的体积选择容量瓶的规格.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
某固体NaOH因吸收了空气中的CO2而含有杂质,若要将该固体配制成较纯的溶液,则其主要的实验操作过程应是( )
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
在甲、乙、丙、丁4只集气瓶中分别装有Cl2、H2、HCl、HBr中的一种气体,纯净的丁点燃能够在甲中安静燃烧,甲、乙两瓶混合后,瓶壁上可见暗红色小液滴.则乙瓶中的气体是( )
| A、HBr |
| B、HCl |
| C、H2 |
| D、Cl2 |
下列化合物中,不能由金属单质和非金属单质直接化合而得到的是( )
| A、FeCl2 |
| B、CaCl2 |
| C、Fe3O4 |
| D、FeCl3 |
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W | 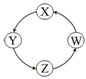 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
常温下,0.1mol?L-1的下列溶液中,有关微粒的物质的量浓度关系正确的( )
| A、(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| D、NaHCO3溶液:c(Na+)+c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |