题目内容
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加盐酸酸化的氯化钡溶液 | 出现白色沉淀 | 该溶液中一定存在SO42 |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | -两者均能与盐酸反应 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 上层溶液 显紫红色 | 氧化性:Fe3+>I2 |
| A、A | B、B | C、C | D、D、 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.向某溶液中加入盐酸酸化的氯化钡溶液,可能生成AgCl或BaSO4沉淀;
B.苏打为碳酸钠,小苏打为碳酸氢钠,与盐酸反应均生成二氧化碳;
C.Cu与硝酸反应生成硝酸铜,溶液变蓝,同时生成NO和水;
D.下层溶液显紫红色,有碘单质生成,则KI和FeCl3溶液反应生成碘单质,结合氧化剂氧化性大于氧化产物氧化性分析.
B.苏打为碳酸钠,小苏打为碳酸氢钠,与盐酸反应均生成二氧化碳;
C.Cu与硝酸反应生成硝酸铜,溶液变蓝,同时生成NO和水;
D.下层溶液显紫红色,有碘单质生成,则KI和FeCl3溶液反应生成碘单质,结合氧化剂氧化性大于氧化产物氧化性分析.
解答:
解:A.向某溶液中加入盐酸酸化的氯化钡溶液,可能生成AgCl或BaSO4沉淀,则该溶液中不一定含有SO42-,不能排除Cl-的影响,故A错误;
B.苏打为碳酸钠,小苏打为碳酸氢钠,与盐酸反应均生成二氧化碳,则观察到均冒气泡,故B正确;
C.Cu与硝酸反应生成硝酸铜,溶液变蓝,同时生成NO和水,该反应不属于置换反应,故C错误;
D.下层溶液显紫红色,有碘单质生成,则KI和FeCl3溶液反应生成碘单质,由氧化剂氧化性大于氧化产物氧化性可知,氧化性为Fe3+>I2,故D错误.
故选B.
B.苏打为碳酸钠,小苏打为碳酸氢钠,与盐酸反应均生成二氧化碳,则观察到均冒气泡,故B正确;
C.Cu与硝酸反应生成硝酸铜,溶液变蓝,同时生成NO和水,该反应不属于置换反应,故C错误;
D.下层溶液显紫红色,有碘单质生成,则KI和FeCl3溶液反应生成碘单质,由氧化剂氧化性大于氧化产物氧化性可知,氧化性为Fe3+>I2,故D错误.
故选B.
点评:本题考查化学实验方案的评价,为高频考点,把握物质的性质及发生的反应为解答的关键,涉及物质的检验、硝酸的性质、氧化还原反应等,综合性较强,题目难度不大.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列操作方法或实验装置正确的是( )
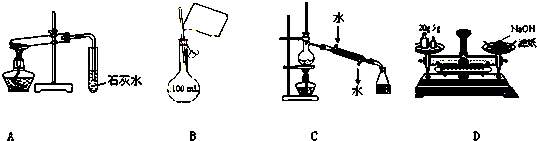

| A、装置探究NaHCO3的热稳定性 |
| B、配制100 mL 0.10 mol?L-1NaCl溶液 |
| C、实验室用该装置制取少量蒸馏水 |
| D、称量25 g NaOH |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、淀粉溶液中:K+、NH4+、SO42-、I2 |
| B、浓氨水中:Na+、K+、Cl-、CO32- |
| C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、CO32-、SO32- |
| D、葡萄糖溶液中:Na+、H+、SO42-、Cr2O72-- |
配制0.1mol?L-1的硫酸500mL,最适宜的一组仪器是( )
| A、托盘天平、烧杯、容量瓶、玻璃棒 |
| B、烧杯、玻璃棒、胶头滴管、量筒 |
| C、烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D、烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
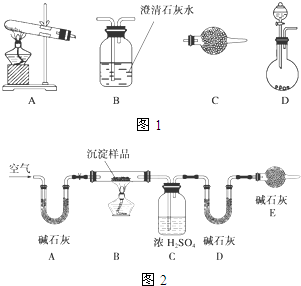 某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)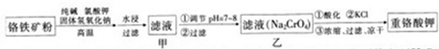
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验: