题目内容
某固体NaOH因吸收了空气中的CO2而含有杂质,若要将该固体配制成较纯的溶液,则其主要的实验操作过程应是( )
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:固体NaOH因吸收了空气中的CO2而含有杂质碳酸钠,要将该固体NaOH配制成较纯的溶液,只要将碳酸钠杂质除去即可,要求选用的除杂试剂不能与原有物质反应,且与杂质反应时不能生成新的杂质,以此来解答.
解答:
解:固体NaOH因吸收了空气中的CO2而含有杂质碳酸钠,要将该固体NaOH配制成较纯的溶液,只要将氢氧化钠中的碳酸钠杂质除去即可.
A.BaCl2溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,会引进杂质氯化钠,故A错误;
B.CaCl2溶液和碳酸钠反应生成碳酸钙沉淀和氯化钠,会引进杂质氯化钠,故B错误;
C.氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,可以用于除去碳酸钠,故C正确;
D.盐酸能与氢氧化钠和碳酸钠反应,不能用作除杂试剂,故D错误.
故选C.
A.BaCl2溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,会引进杂质氯化钠,故A错误;
B.CaCl2溶液和碳酸钠反应生成碳酸钙沉淀和氯化钠,会引进杂质氯化钠,故B错误;
C.氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,可以用于除去碳酸钠,故C正确;
D.盐酸能与氢氧化钠和碳酸钠反应,不能用作除杂试剂,故D错误.
故选C.
点评:本题考查混合物的分离和提纯,为高频考点,侧重于考查学生的分析能力,题目难度不大,注意把握混有的杂质为碳酸钠及除杂发生的化学反应.

练习册系列答案
相关题目
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、淀粉溶液中:K+、NH4+、SO42-、I2 |
| B、浓氨水中:Na+、K+、Cl-、CO32- |
| C、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、CO32-、SO32- |
| D、葡萄糖溶液中:Na+、H+、SO42-、Cr2O72-- |
 在25mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线 如图所示,下列有关离子浓度的关系正确的是( )
在25mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线 如图所示,下列有关离子浓度的关系正确的是( )| A、在A、B间,溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C、在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D、在D点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
配制0.1mol?L-1的硫酸500mL,最适宜的一组仪器是( )
| A、托盘天平、烧杯、容量瓶、玻璃棒 |
| B、烧杯、玻璃棒、胶头滴管、量筒 |
| C、烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D、烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再滴入少量碱溶液调至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.则有关操作的原理或说法不符合的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化:2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
下列有关原电池的说法正确的是( )
| A、是把电能转化为化学能的装置 |
| B、负极发生还原反应 |
| C、正极失去电子 |
| D、电流由正极经导线流向负极 |
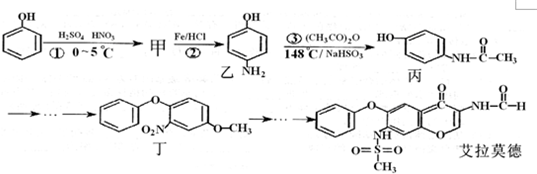
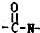 ,所以它属于二肽
,所以它属于二肽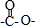 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3, 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验: