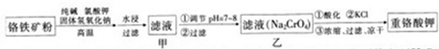
题目内容
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W | 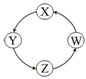 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
考点:铜金属及其重要化合物的主要性质,氯、溴、碘及其化合物的综合应用,钠的重要化合物,铁盐和亚铁盐的相互转变
专题:
分析:①Cu与浓硫酸反应生成硫酸铜,硫酸铜与氢氧化钠反应生成氢氧化铜,氢氧化铜加热分解生成氧化铜,氧化铜被还原生成Cu;
②钠与水反应生成氢氧化钠,氢氧化钠与碳酸反应生成碳酸钠,碳酸钠与稀盐酸反应生成氯化钠,氯化钠熔融电解生成钠;
③氯气与石灰乳生成次氯酸钙,次氯酸钙与稀盐酸生成次氯酸,次氯酸光照分解生成HCl,HCl电解生成氯气;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe.
②钠与水反应生成氢氧化钠,氢氧化钠与碳酸反应生成碳酸钠,碳酸钠与稀盐酸反应生成氯化钠,氯化钠熔融电解生成钠;
③氯气与石灰乳生成次氯酸钙,次氯酸钙与稀盐酸生成次氯酸,次氯酸光照分解生成HCl,HCl电解生成氯气;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe.
解答:
解:①Cu与浓硫酸反应生成硫酸铜,硫酸铜与氢氧化钠反应生成氢氧化铜,氢氧化铜加热分解生成氧化铜,氧化铜被还原生成Cu,故正确;
②钠与水反应生成氢氧化钠,氢氧化钠与碳酸反应生成碳酸钠,碳酸钠与稀盐酸反应生成氯化钠,氯化钠熔融电解生成钠,故正确;
③氯气与石灰乳生成次氯酸钙,次氯酸钙与稀盐酸生成次氯酸,次氯酸光照分解生成HCl,HCl电解生成氯气,故正确;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故错误,故选A.
②钠与水反应生成氢氧化钠,氢氧化钠与碳酸反应生成碳酸钠,碳酸钠与稀盐酸反应生成氯化钠,氯化钠熔融电解生成钠,故正确;
③氯气与石灰乳生成次氯酸钙,次氯酸钙与稀盐酸生成次氯酸,次氯酸光照分解生成HCl,HCl电解生成氯气,故正确;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故错误,故选A.
点评:本题主要考查的是常见元素化合物之间的转化,熟练掌握各种物质的性质是解决本题的关键,属于中等难度题目.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
配制0.1mol?L-1的硫酸500mL,最适宜的一组仪器是( )
| A、托盘天平、烧杯、容量瓶、玻璃棒 |
| B、烧杯、玻璃棒、胶头滴管、量筒 |
| C、烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D、烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
下列说法正确的是( )
| A、常用危险化学品包括:强氧化剂、压缩气体、液化气体、放射性物质等 |
| B、以mol为单位,可以计量分子、原子、质子、电子、胶体粒子等微观粒子 |
| C、物质体积的大小,取决于组成物质粒子的大小和粒子间的距离 |
| D、制备蒸馏水时,当一出现馏出液时应立即收集 |
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再滴入少量碱溶液调至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.则有关操作的原理或说法不符合的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化:2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
| A、氯化氢 | B、溴水 |
| C、氯气 | D、碘的酒精溶液 |
可逆反应N2(g)+3H2(g)?2NH3(g),△H=-Q KJ/mol(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2.下列叙述不正确的是( )
| A、达到平衡时,两容器中反应物的转化率不同 |
| B、达到平衡时,甲中NH3的体积分数与乙相等 |
| C、达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
| D、乙中的热化学反应方程式为2NH3(g)?N2(g)+3H2(g);△H=+Q2KJ/mol |