题目内容
12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素,Y元素形成的化合物种类最多,Z是短周期中金属性最强的元素,W的单质是一种黄色晶体或粉末.下列说法不正确的是( )| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |
分析 X是元素周期表中原子半径最小的元素,应为H元素,Y元素形成的化合物种类最多,为C元素,Z是短周期中金属性最强的元素,为Na元素,W的单质是一种黄色晶体或粉末,为S元素,则R为C元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为H、Y为C、Z为Na、W为S、R为Cl元素.
A.Na离子比S离子少一个电子层,离子半径较小,故A错误;
B.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.NaH只含有离子键,Na和S形成原子个数比1:1的化合物含有离子键和共价键,故C正确;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故D正确.
故选A.
点评 本题考查位置结构性质关系、元素化合物知识,为高频考点,侧重考查学生的分析能力,难度中等,注意把握元素周期率的递变规律以及原子的结构特点,把握核外电子的排布规律.

练习册系列答案
相关题目
2.下列关于烷烃性质的叙述中,不正确的是( )
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |
3.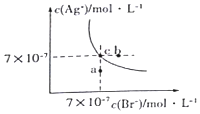 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |
17.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 实验室用排饱和食盐水的方法收集氯气 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
2.三氯化硼(BCl3)是一种重要的化工原料.某兴趣小组拟选用下列装置(装置可重复使用),用氯气和硼制备BCl3(已知BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸).

(1)装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)上述装置连接顺序为AACFBDECACFBDEF.
(3)装置A中a管的作用是导气.装置B中饱和食盐水的作用吸收氯气中的氯化氢气体.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
表格中b值为2.0,通过实验得出的结论是氯化钠浓度越大、溶液碱性越强次氯酸钠漂白性越弱.

(1)装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)上述装置连接顺序为AACFBDECACFBDEF.
(3)装置A中a管的作用是导气.装置B中饱和食盐水的作用吸收氯气中的氯化氢气体.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |