题目内容
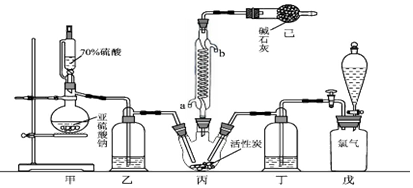
2.三氯化硼(BCl3)是一种重要的化工原料.某兴趣小组拟选用下列装置(装置可重复使用),用氯气和硼制备BCl3(已知BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸).
(1)装置A中反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)上述装置连接顺序为AACFBDECACFBDEF.
(3)装置A中a管的作用是导气.装置B中饱和食盐水的作用吸收氯气中的氯化氢气体.
(4)已知:硼酸(H3BO3)是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(5)实验完成后,该小组同学向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色,现设计对照实验探究溶液褪色的影响因素.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| Ⅰ | 4.0 | 2.0 | 0 | 2.0 | 3滴 | 较快褪色 |
| Ⅱ | 4.0 | 4.0 | 0 | 0 | 3滴 | 缓慢褪色 |
| Ⅲ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
| Ⅳ | 4.0 | 0 | 2.0 | b | 3滴 | 较快褪色 |
分析 根据实验装置图可知,A装置制备氯气,发生反应为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,C装置吸收氯气中混有的HCl,用饱和食盐水,F中浓硫酸吸水,干燥氯气,B中氯气与硼粉反应生成三氯化硼,三氯化硼的沸点较低,所以D装置中用冰水浴冷却收集三氯化硼,尾气中有氯气,用E装置中的碱石灰吸收,同时吸收空气中的水蒸气,据此分析解答.
解答 解:(1)根据装置A的药品和反应条件可知该装置是实验室制备氯气的装置,其中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)A装置制备氯气,C装置吸收氯气中混有的HCl,用饱和食盐水,F中浓硫酸吸水,干燥氯气,B中氯气与硼粉反应生成三氯化硼,三氯化硼的沸点较低,所以D装置中用冰水浴冷却收集三氯化硼,尾气中有氯气,用E装置中的碱石灰吸收;
故答案为:ACFBDE;
(3)装置A中a管的作用是导气;制得的氯气中混有氯化氢,装置B中饱和食盐水的作用吸收氯化氢气体;
故答案为:导气;吸收氯气中氯化氢气体;
(4)硼酸在水中的电离方程式是H3BO3+H2O?[B(OH)4]-+H+;
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(5)向F中(溶液含有NaClO、NaCl、NaOH)滴加品红溶液,发现溶液褪色.探究溶液褪色的原因,三组对比试验应溶液总体积相同,都为8mL溶液,故实验Ⅳ水为2.0mL,实验Ⅰ、Ⅳ褪色较快,实验Ⅱ、Ⅲ褪色较慢,说明氯化钠浓度越大、溶液碱性越强次氯酸钠漂白性越弱;
故答案为:2.0;氯化钠浓度越大、溶液碱性越强次氯酸钠漂白性越弱.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |
| A. | 在标准状况下,1mol O2 与1mol 纯碱的体积相同 | |
| B. | 常温常压下,18g H2O所含的氧原子的数目为NA | |
| C. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| D. | 1L 水溶解58.5g NaCl 所形成的溶液的物质的量浓度是0.1mol•L-1 |
| A. | 1.0 L 0.5mol/L的Na2SO4水溶液中含有的氧原子数为2NA | |
| B. | 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中,胶粒数等于0.2NA | |
| C. | 1.0g H2O与D2O的混合物所含中子数为0.5NA | |
| D. | 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为NA |
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |