题目内容
14. 写出下列微粒的化学式
写出下列微粒的化学式(1)由两个原子核和18个电子组成的分子HCl,由两个原子核和18个电子组成的阴离子为HS-,由4个原子核和18个电子组成的分子PH3
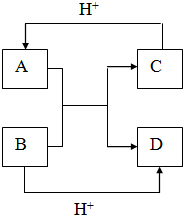
(2)已知A、B、C、D均含有两种元素,其中A、B是10电子离子.C、D是10电子分子.它们之间存在如图所示的转化关系,请写出A、B、C、D四种不同微粒的化学式:
ANH4+BOH-CNH3DH2O
与出A离子与B反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 (1)两个原子核和18个电子组成的分子为HCl,由两个原子核和18个电子组成的阴离子为HS-,由4个原子核和18个电子组成的分子PH3;
(2)A、B是10电子离子,C、D是10电子分子,发生反应A+B=C+D,A、B、C、D均含有两种元素,判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O.
解答 解:(1)两个原子核和18个电子组成的分子为HCl,由两个原子核和18个电子组成的阴离子为HS-,由4个原子核和18个电子组成的分子PH3.
故答案为:HCl;HS-;PH3;
(2)A、B是10电子离子,C、D是10电子分子,发生反应A+B=C+D,A、B、C、D均含有两种元素,判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O,
OH-、NH4+反应生成NH3、H2O,反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4+;OH-;NH3;H2O;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,注意常见10电子和18电子物质的种类和性质,结合转化关系可判断出物质的种类,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
5.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 碱性溶液中:Na+、S2-、SO32-、AlO2- | |
| C. | 酸性溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
2.设阿伏加德罗常数的值为NA,下列说法不正确的是( )
| A. | 18gH218O与D2O的混合物中所含中子数为9NA | |
| B. | 60g HCHO和CH3COOH的混合物中存在的共用电子对总数为8NA | |
| C. | 反应N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3中,当净生成0.2mol NH3生产时,在正反应中N2得到0.6NA电子 | |
| D. | 电解精炼铜中,当阴极增重3.2g时,阳极失去电子0.1NA |
19.一定温度下,某容器中加入足量碳酸钙,发生反应CaC03(s)=CaO(s)+CO2(g)达到平衡.下列说法正确的是( )
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
1.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| D. | 氯化亚铁溶液中通入氯气:Cl2+2Fe2+═2Fe3++2Cl- |
 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题: