题目内容
3.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |
分析 A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进;
B.常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后,溶液中溶质为等物质的量CH3COONa和CH3COOH,醋酸的电离程度大于醋酸根离子的水解程度;
C.根据混合液中的电荷守恒、物料守恒判断;
D.0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中溶质为(NH4)2C2O4,根据物料守恒分析.
解答 解:A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,所以,相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③,故A错误;
B.常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后,溶液中溶质为等物质的量CH3COONa和CH3COOH,醋酸的电离程度大于醋酸根离子的水解程度,则溶液显酸性,所以溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B正确;
C.0.1mol•L-1Na2CO3溶液与0.2mol•L-1NaHCO3溶液等体积混合,则碳酸钠和碳酸氢钠的浓度的一半,根据电荷守恒可得:①2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据电荷守恒可得:②3c(Na+)=4c(CO32-)+4c(H2CO3)+4c(HCO3-),根据①②可得:2c(CO32-)+3c(OH-)=c(HCO3-)+4c(H2CO3)+3c(H+),故C错误;
D.0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中溶质为(NH4)2C2O4,(NH4)2C2O4溶液中物料守恒为:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4),故D正确.
故选BD.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,注意掌握盐的水解原理、酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.

Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
| A. | 二氧化硫通入溴水使其褪色 SO2+Br2+2H2O═4H++2Br-+SO32- | |
| B. | 石灰石与稀盐酸 CO32-+2H+═H2O+CO2↑ | |
| C. | 小苏打溶液中滴加醋酸溶液 HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ | |
| D. | 氯化铝溶液中加入过量的氨水 Al3++4 NH3•H2O=4NH4++AlO2-+2H2O |
| A. | CO与CO2均为酸性氧化物 | B. | CO是煤气的主要成分之一 | ||
| C. | CO2是弱电解质 | D. | 大量CO2的排放可导致酸雨的形成 |
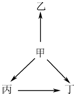 下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | N2 | NH3 | NO | NO2 |
| B | Na | Na2O | NaOH | Na2O2 |
| C | SiO2 | SiF4 | H2SiO3 | Na2SiO3 |
| D | Al | AlCl3 | Al2O3 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH<7的溶液中:S${{O}_{4}}^{2-}$、C${{O}_{3}}^{2-}$、Na+、K+ | |
| B. | 使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO- | |
| C. | 0.1 mol•L-1 NH4Al(SO4)2溶液中:Al${{O}_{2}}^{-}$、Mg2+、Cl-、S${{O}_{4}}^{2-}$ | |
| D. | $\frac{{c(H}^{+})}{{c(OH}^{-})}$=1012的溶液中:Na+、Ba2+、N${{O}_{3}}^{-}$、ClO- |
 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCI)=20 mL时,有:c(Cl-)>c(N${{H}_{4}}^{+}$)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(N${{H}_{4}}^{+}$)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(N${{H}_{4}}^{+}$)-c(NH3•H2O) |
| A. | 166 | B. | 99 | C. | 67 | D. | 32 |
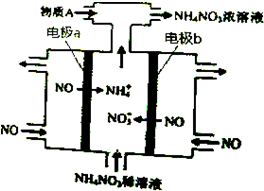
| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |