题目内容
7.活泼金属的碳化物都是易水解的物质,例如:Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出乙炔的物质的量,再结合反应方程式CaC2+2H2O=Ca(OH)2+C2H2↑计算出需要CaC2含量为96%的电石的质量;
(2)①根据表中数据可知,①②中碳化物不足,水过量,可设出①中Al4C3、Mg2C3的物质的量,然后分别根据质量和生成气体体积列式计算;
②根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、Mg2C3+4H2O→2Mg(OH)2+C3H4↑可知,参与反应的水的物质的量是生成气体的物质的量的4倍,据此计算出水的物质的量及质量;
(3)发生反应为:反应Al4C3+12H2O→4Al(OH)3+3CH4↑、CaC2+2H2O=Ca(OH)2+C2H2↑;烧瓶质量减轻了7.4g,减轻的质量为生成气体的质量,根据n=$\frac{V}{{V}_{m}}$计算出生成甲烷和乙炔的总物质的量,然后设甲烷的物质的量为x、乙炔的物质的量为y,分别根据质量和气体的量列式计算出生成甲烷和乙炔的物质的量;再根据n=$\frac{m}{M}$计算出C的物质的量、设出主反应中分解的甲烷为的物质的量,分别根据反应甲烷分解的方程式计算出分解后混合气体中含有乙炔、甲烷和氢气的物质的量,再结合平均分子质量及质量守恒列式计算出主反应中分解的甲烷的物质的量,最后计算出甲烷分解的总物质的量及分解率.
解答 解:(1)标况下10.08L乙炔的物质的量为:$\frac{10.08g}{22.4L/mol}$=0.45mol,设需要CaC2含量为96%的电石的质量为xg,根据反应CaC2+2H2O=Ca(OH)2+C2H2↑可知,$\frac{96%x}{64}$=0.45mol,解得:x=30
答案为:30
2)①根据表中数据可知,①②中随着碳化物质量的增加,生成气体体积增大,③④中生成气体体积相等,而碳化物的质量不同,说明①②中碳化物不足、水过量,而③④中水完全反应,碳化物过量,
设①中Al4C3、Mg2C3的物质的量分别为x、y,根据质量可得:144x+84y=7.8,根据生成气体体积可得:3x+y=$\frac{2.8}{22.4}$=0.125,联立解得:x=0.025mol、y=0.05mol,故混合物中Al4C3与Mg2C3的物质的量之比为:0.025mol:0.05mol=1:2,
故答案为:1:2;
②根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、Mg2C3+4H2O→2Mg(OH)2+C3H4↑可知,参与反应的水的物质的量是生成气体的物质的量的4倍,③④中水不足,完全反应,则参与反应的水的物质的量为:$\frac{7L}{22.4L/mol}$×4=1.25mol,水的质量为:22.5g,
故答案为:22.5g;
(3)烧瓶质量减轻了7.4g,减轻的质量为生成气体的质量,根据反应Al4C3+12H2O→4Al(OH)3+3CH4↑、CaC2+2H2O=Ca(OH)2+C2H2↑可知,生成气体为乙炔和甲烷,总物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,设甲烷的物质的量为x、乙炔的物质的量为y,则x+y=0.4、16x+26y=7.4g,联立解得:x=0.3mol、y=0.1mol,
0.03gC的物质的量为:$\frac{0.03g}{12g/mol}$=0.0025mol,根据副反应CH4→C(s)+2H2可知,反应分解的甲烷的物质的量为0.0025mol,生成氢气的物质的量为:0.0025mol×2=0.005mol,
设主反应2CH4→C2H2+3H2中甲烷分解的物质的量为xmol,则反应生成乙炔的物质的量为0.5xmol,生成氢气的物质的量为1.5xmol,
甲烷分解后的气体中含有乙炔的物质的量为:(0.1+0.5x)mol,甲烷的物质的量为:(0.3-x-0.0025)mol=(0.2975-x)mol,氢气的物质的量为:(0.005+1.5x)mol,分解后气体的质量为:7.4g-0.03g=7.37g,
根据平均分子质量为11,平均摩尔质量为11g/mol,则:11g/mol×(0.1+0.5x+0.2975-x+1.5x+0.005)mol=7.37g,解得:x=0.272mol,
甲烷分解的总物质的量为:0.272mol+0.0025mol=0.2745mol,
所以甲烷的分解率为:$\frac{0.2745mol}{0.3mol}$×100%=91.5%,
答:甲烷的分解率为91.5%.
点评 本题考查了混合物反应的计算,题目难度较大,注意明确讨论法、平均摩尔质量及质量守恒定律在化学计算中的应用,(3)为难点,涉及的计算量较大,充分考查了学生的分析、理解能力.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
| A. | N | B. | S | C. | F | D. | Cl |
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤
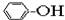 ⑥
⑥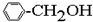 ⑦
⑦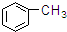 ⑧
⑧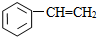
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |
| A. | BaCl2 | B. | AlCl3 | C. | HCl | D. | Na2O2 |
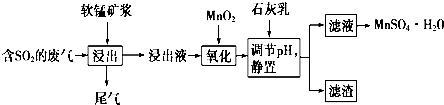
已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |