题目内容
14.下列反应的离子方程式书写正确的是( )| A. | 二氧化硫通入溴水使其褪色 SO2+Br2+2H2O═4H++2Br-+SO32- | |
| B. | 石灰石与稀盐酸 CO32-+2H+═H2O+CO2↑ | |
| C. | 小苏打溶液中滴加醋酸溶液 HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ | |
| D. | 氯化铝溶液中加入过量的氨水 Al3++4 NH3•H2O=4NH4++AlO2-+2H2O |
分析 A.二氧化硫被氧化成硫酸,反应产物中为硫酸根离子,不是亚硫酸根离子;
B.石灰石的主要成分为碳酸钙,碳酸钙不能拆开;
C.小苏打为碳酸氢钠,碳酸氢钠与醋酸反应生成醋酸钠、二氧化碳气体和水;
D.氨水为弱碱,二者反应生成氢氧化铝沉淀.
解答 解:A.二氧化硫通入溴水使其褪色,二者反应生成硫酸和溴化氢,反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42-,故A错误;
B.碳酸钙与稀盐酸反应生成氯化钙和水,碳酸钙需要保留化学式,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.小苏打溶液中滴加醋酸溶液,反应生成醋酸钠、二氧化碳气体和水,反应的离子方程式为:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑,故C正确;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:据此是否遵循电荷守恒,难溶物、弱电解质是否充分等,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
18.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
5.软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制高纯度的硫酸锰晶体,其流程如图所示:

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
2.饱和氯水中存在如下平衡:①Cl2+H2O?H++Cl-+HClO;②HClO?H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是( )
| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
19.如图是一套电化学装置,a、b、c、d都是石墨电极,对其有关说法错误的是( )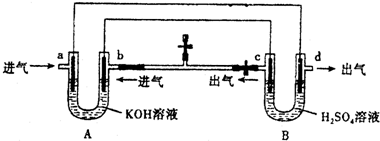

| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |
6.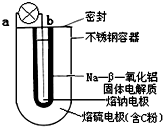 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )| A. | 放电时b为电池的负极 | |
| B. | 充电时阴极反应式为:Na++e-=Na | |
| C. | 充电时,阳极处发生还原反应 | |
| D. | 放电时Na+可以穿过固体电解质流向a电极 |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |
4.下列有关物质检验的实验结论中正确的组合是( )
| 实验操作 | 现象 | 实验结论 | |
| ① | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| ② | 将无色气体通入溴水中 | 溴水的黄色褪去 | 该气体可能是乙烯 |
| ③ | 向某溶液中滴入两滴KSCN溶液 | 溶液不显红色 | 该溶液一定含有Fe2+ |
| 另取该溶液少许,先滴入氯水,再 滴入KSCN溶液 | 溶液为红色 | ||
| ④ | 向某溶液中加入盐酸酸化的氯化钡 溶液 | 有白色沉淀产生 | 该溶液中可能含有SO42- |
| ⑤ | 将木炭和浓硫酸反应生成的气体通入 澄清石灰水中 | 有白色沉淀生成 | 该气体一定是CO2 |
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②③④⑤ |
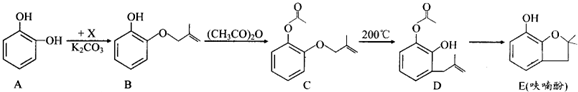
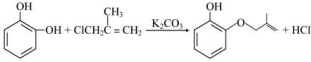 ;
; ;
;