题目内容
13.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )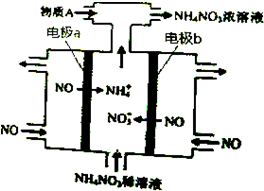
| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
分析 电解NO制备NH4NO3,b为阳极反应为NO-3e-+2H2O=NO3-+4H+,a为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
解答 解:电解NO制备NH4NO3,b为阳极反应为NO-3e-+2H2O=NO3-+4H+,a为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
A.b为阳极反应为:NO-3e-+2H2O=NO3-+4H+,故A正确;
B.溶液中的H+由电极b处向电极a处迁移,故B错误;
C.根据以上分析,总反应方程式为8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,故C正确;
D.根据以上分析,则A为NH3,故D正确;
故选:B.
点评 本题考查了电解原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |
4.下列有关物质检验的实验结论中正确的组合是( )
| 实验操作 | 现象 | 实验结论 | |
| ① | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| ② | 将无色气体通入溴水中 | 溴水的黄色褪去 | 该气体可能是乙烯 |
| ③ | 向某溶液中滴入两滴KSCN溶液 | 溶液不显红色 | 该溶液一定含有Fe2+ |
| 另取该溶液少许,先滴入氯水,再 滴入KSCN溶液 | 溶液为红色 | ||
| ④ | 向某溶液中加入盐酸酸化的氯化钡 溶液 | 有白色沉淀产生 | 该溶液中可能含有SO42- |
| ⑤ | 将木炭和浓硫酸反应生成的气体通入 澄清石灰水中 | 有白色沉淀生成 | 该气体一定是CO2 |
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②③④⑤ |
1.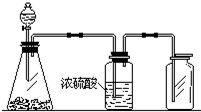 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碳酸钙和稀盐酸 | B. | 二氧化锰和浓盐酸 | ||
| C. | 锌粒和稀硫酸 | D. | 碱石灰和浓氨水 |
5.下列说法正确的是( )
| A. | 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO?)+c(Cl?)+c(HClO) | |
| D. | 用1L 0.2 mol•L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-) |
3.用下列装置进行相应实验,能达到实验目的是( )
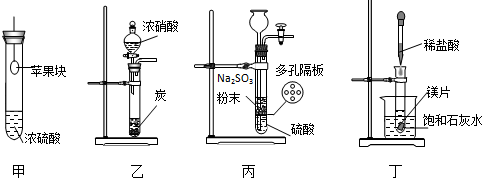

| A. | 用装置甲验证浓硫酸的脱水性和强氧化性 | |
| B. | 用装置乙验证浓硝酸的强氧化性 | |
| C. | 用装置丙制备SO2气体 | |
| D. | 用装置丁验证镁片与稀盐酸反应放热 |
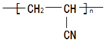 路线:
路线:
 .
. .
. .
.