题目内容
11.科学家观测到固体催化剂表面“抓取”一氧化碳分子和氧原子配对生成二氧化碳分子的过程.下列关于碳的氧化物的说法正确的是( )| A. | CO与CO2均为酸性氧化物 | B. | CO是煤气的主要成分之一 | ||
| C. | CO2是弱电解质 | D. | 大量CO2的排放可导致酸雨的形成 |
分析 A.CO是不成盐氧化物;
B.煤气的主要成分CO和氢气等;
C.CO2在熔融状态下和水溶液中都不能发生电离,属于非电解质;
D.二氧化碳不会形成酸雨.
解答 解:A.CO是不成盐氧化物,CO2为酸性氧化物,故A错误;
B.煤气的主要成分CO和氢气等,则CO是煤气的主要成分之一,故B正确;
C.CO2在熔融状态下和水溶液中都不能发生电离,属于非电解质,二氧化碳不是电解质,故C错误;
D.二氧化碳不会形成酸雨,二氧化碳对环境的影响是产生温室效应,故D错误.
故选B.
点评 本题考查了一氧化碳与二氧化碳的性质,题目难度不大,注意把握酸性氧化物和电解质的概念.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
15.元素中最高正价与负价绝对值的差等于6的是( )
| A. | N | B. | S | C. | F | D. | Cl |
2.饱和氯水中存在如下平衡:①Cl2+H2O?H++Cl-+HClO;②HClO?H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是( )
| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
19.如图是一套电化学装置,a、b、c、d都是石墨电极,对其有关说法错误的是( )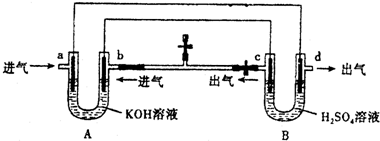

| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |
6.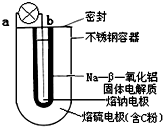 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )| A. | 放电时b为电池的负极 | |
| B. | 充电时阴极反应式为:Na++e-=Na | |
| C. | 充电时,阳极处发生还原反应 | |
| D. | 放电时Na+可以穿过固体电解质流向a电极 |
16.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: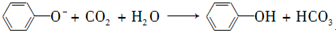 - - |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(N${{H}_{4}}^{+}$)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(C${{O}_{3}}^{2-}$)+2c(OH-)=c(HC${{O}_{3}}^{-}$)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(N${{H}_{4}}^{+}$)+c(NH3•H2O)=2c(C2${{O}_{4}}^{2-}$)+2c(HC2${{O}_{4}}^{-}$)+2c(H2C2O4) |
1.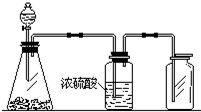 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碳酸钙和稀盐酸 | B. | 二氧化锰和浓盐酸 | ||
| C. | 锌粒和稀硫酸 | D. | 碱石灰和浓氨水 |
