题目内容
12.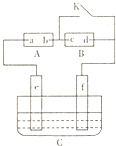 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:(1)电源A的a为正极;
(2)滤纸B上发生的总化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
(3)欲在电镀槽中实现铁上镀锌,接通K点,则电极e上发生的反应为:Zn-2e=Zn2+槽中盛放的电镀液可以是ZnSO4、Zn(NO3)2.
分析 (1)由B上的c点显红色判断c的电极,根据c的电极判断a、b的电极;
(2)根据溶液中离子的放电顺序判断生成物,由反应物、生成物写出相应的方程式.
(3)先判断e、f的电极,再根据阴阳极上发生的反应写出相应的电极反应式;根据电镀原理选取电解质;
解答 解:(1)B外接电源,所以B是电解氯化钠溶液的电解池;B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上氢离子得电子放电,所以c是阴极,外电源b是负极,a是正极.
故答案为:正;
(2)电解氯化钠溶液时,溶液中的离子放电顺序为:氢离子放电能力大于钠离子,氯离子放电能力大于氢氧根离子,所以电解氯化钠时生成物是氯气、氢气、氢氧化钠,所以其反应方程式为 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极上电极反应式为Zn-2e-=Zn2+;阴极上的电极反应式为Zn2++2e-=Zn;
电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4、Zn(NO3)2溶液作电镀液.
故答案为:Zn-2e=Zn2+;ZnSO4、Zn(NO3)2.
点评 本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,明确各个电极上发生的反应是解本题关键,注意把握电解池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
18.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 纯银制品在空气中久置变黑,是因为发生了电化学腐蚀 | |
| B. | 氨常用作制冷剂,是因为其沸点极低,易液化 | |
| C. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化 | |
| D. | 明矾具有强氧化性,可用作净水剂 |
3.为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;( )
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;( )
| A. | ③④⑤⑥ | B. | ①③④⑤ | C. | ①②③⑥⑦ | D. | ①②③④⑤⑥ |
20.若NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | NA个Cl2在常温常压下体积约为22.4L | |
| B. | 在20℃、101kPa时,22.4L氢气中约含有2NA个氢原子 | |
| C. | 25℃、1.01×105Pa,48g SO2中含有的原子数为3NA | |
| D. | 22 g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
7. 美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
 美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | b极发生氧化反应 | |
| C. | 负极的反应为:4H++O2+4e-═2H2O | |
| D. | 电池工作时,1mol乙醇被氧化时有12mol转移 |
17.2.3g钠在干燥的空气中与O2反应,可得3.5g氧化物,据此可判断其产物为( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
4.下图所示的实验操作,不能达到相应目的是( )
| A. |  干燥Cl2 | B. |  检验K2CO3中的K+ | ||
| C. |  证明HCl极易溶于水 | D. |  实验室制氨气 |
1.下列递变情况正确的是( )
| A. | Na、Mg、Al最外层电子数依次增多,其还原性依次增强 | |
| B. | P、S、Cl最高正价依次升高,对应气态氢化物稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na和K属于第ⅠA族元素,其氧化物的水化物碱性:NaOH比KOH强 |
2.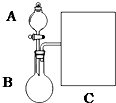 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04ml,计算上述氨水的物质的量浓度0.01002 mol/L.
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |