题目内容
15.已知A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数;B原子的最外层电子数是其电子层数的2倍;D的最外层电子数是其电子层数的3倍;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,E、F、G的最外层电子数之和为10.回答下列问题.(1)元素D、F的名称氧、铝;
(2)C元素在周期表中的位置第二周期ⅤA族;
(3)用电子式表示D,E两元素形成的1:1的化合物的形成过程
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键(4)写出分别由A、D、E、G四种元素组成的两种化合物反应的化学方程式NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑;
(5)写出E、F的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
分析 A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10-1-3=6,为S元素,以此解答该题.
解答 解:A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10-1-3=6,为S元素,
(1)由以上分析可知D为氧元素,F为铝元素,故答案为:氧;铝;
(2)C为N元素,位于周期表第二周期ⅤA族,故答案为:第二周期ⅤA族;
(3)D,E两元素形成的1:1的化合物为过氧化钠,为离子化合物,含有离子键和共价键,形成过程为 ,
,
故答案为: ;离子键、共价键;
;离子键、共价键;
(4)由A、D、E、G四种元素组成的两种盐为NaHSO4、NaHSO3,二者反应生成二氧化硫和水,反应的化学方程式为NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑,
故答案为:NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑;
(5)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,离子反应方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查了元素位置结构性质的相互关系及应用,为高考常见题型,根据原子结构、元素周期表结构确定元素,再结合物质的性质来分析解答,正确推断元素是解本题关键根据,题目难度中等.

| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲组 | c(HA)=0.2mol/L | c(NaOH)=0.2mol/L | pH=a |
| 乙组 | c(HA)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丙组 | pH=2 | pH=12 | pH=b |
(1)从甲组实验结果可以判断HA酸性的强弱.当a=7(填“<、>或=”,下同),HA为强酸;当a>7,HA为弱酸.
(2)从乙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+),.
(3)从丙组实验可知,HA和NaOH溶液混合前c(HA)>c(NaOH) (填“<、>或=”,下同),混合后溶液的pH为:b<7.
| A. | 元素周期表里属于过渡元素的化合物 | |
| B. | 位于元素周期表里第ⅡA族元素的化合物 | |
| C. | 位于元素周期表里第ⅢA族元素的化合物 | |
| D. | 位于元素周期表里第ⅣA族元素的化合物 |
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| B. | 标准状况下,含NA个共价键的HF分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数小于2NA |
 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
| A. | 该有机物不能发生加成反应,但能发生取代反应 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物的一溴代物最多有11种 |
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY | |
| B. | 若a=b,并测得溶液中c(X-)=c(Y-)+c(HY)(c(HY)≠0),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,并测得溶液中c(HX)=c(HY),则可推出溶液中c(X-)>c(Y-),且相同浓度时,酸性HX>HY | |
| D. | 若两溶液等体积混合,测得溶液中c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol/L,则可推出a+b=0.2 mol/L |
①称取3.920g摩尔盐样品配制250mL溶液.
②取少量配制溶液,加入KSCN溶液,无明显现象.
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
④定量测定如下:
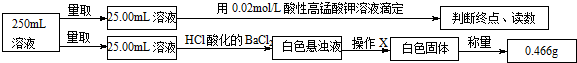
滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)步骤①中需要的定量仪器为电子天平、250mL容量瓶.
(2)步骤②的目的是确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在.产生红褐色沉淀的离子方程式4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓.
(3)步骤④中操作X为过滤、洗涤、干燥或烘干(冷却)(按操作顺序填写).
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,不能(填“能”或“不能”),请说明理由碘单质与亚铁离子不反应.
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将偏小.(选填“偏大”、“偏小”或“不变”).
(6)通过上述实验测定结果,推断摩尔盐化学式为(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
 营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.
营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.