题目内容
13.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-283.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11 036 kJ/mol |
分析 燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量.一般C→CO2,H→H2O(l),S→SO2.燃烧热是物质的性质,与量的多少无关.
解答 解:A、该反应的焓变是完全燃烧1mol碳单质生成最稳定的产物二氧化碳的反应热,符合燃烧热的内涵,故A正确;
B、该反应的焓变不是完全燃烧1mol碳单质生成最稳定的产物二氧化碳的反应热,此焓变不是燃烧热,故B错误;
C、氢气燃烧的最稳定产物是液态的水,不能是气态的水,此焓变不是燃烧热,故C错误;
D、该反应的焓变不是完全燃烧1mol辛烷的反应热,此焓变不是燃烧热,故D错误;
故选A.
点评 考查燃烧热的概念,难度较小,注意把握燃烧热的含义可燃物为1mol,一般C→CO2,H→H2O(l),S→SO2.

练习册系列答案
相关题目
3.下列变化属于物理变化的是( )
| A. | 用乙烯合成聚乙烯 | |
| B. | 分馏石油得到汽油、柴油、重油等产物 | |
| C. | 铝铁在冷、浓硫酸中钝化 | |
| D. | 食物腐败变酸 |
4.下列实验与对应的图象符合的是( )
| A. |  若采用图示装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| B. |  向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 | |
| C. |  达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| D. |  将pH=2的盐酸和醋酸分别加水稀释,a点溶液中水的电离程度比b点溶液中水的电离程度大 |
1.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
18.下列各组离子在碱性溶液中能够大量共存的是( )
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
5.下列说法不正确的是( )
| A. | 推广使用氢能、太阳能,减少化石燃料的使用,有助于减少雾霾天气的发生 | |
| B. | 将太阳能转化为氢能是减少污染、缓解能源危机的一种构想 | |
| C. | 石油的分馏、催化裂化、裂解等石油的加工方法,其目的均为得到更多的汽油 | |
| D. | 煤干馏可以得到煤焦油,煤焦油进一步分离又可得到苯、甲苯等有机物 |
11.已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用下图装置进行中和热的测定,请回答下列问题:
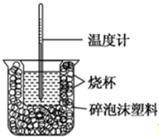
(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
①比较△H1和△H2的相对大小:△H1<△H2(填“>”“<”或“=”).
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.

(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.
12.下列微粒中,最外层未成对电子数最多的是( )
| A. | O | B. | P | C. | Br | D. | Fe3+ |