题目内容
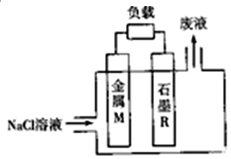
15.研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )
| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
分析 A、是吸氧腐蚀;
B、金属作电解池的阴极被保护;
C、锌比铁活泼,所以锌失电子;
D、海水是混合物.
解答 解:A、是吸氧腐蚀,a极是氧气得电子生成氢氧根离子,而铁是负极发生氧化反应生成亚铁离子,铁被腐蚀,故A错误;
B、金属作电解池的阴极被保护,而铁与电源正极相连是阳极发生氧化反应,故B错误;
C、锌比铁活泼,所以锌失电子,所以③中采用了牺牲阳极的阴极保护法保护桥墩,故C正确;
D、海水是混合物,不是化合物,既不是电解质,也不是非电解质,故D错误;
故选C.
点评 本题考查电化学防护措施等,侧重于学生的分析能力和实验能力的考查,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
1.下列说法正确的是( )
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
20.工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同).下列说法中,不正确的是( )
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
7. 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )| A. | 电池工作时,电子沿M电极→电解质溶液→R电极流动 | |
| B. | 电池工作时,正极附近溶液的pH增大 | |
| C. | 在锌、铁、铝、锂中,锂的比能量最高 | |
| D. | 若M为锌时,电池反应为 Zn+2H2O═Zn(OH)2+H2↑ |
4.下列物质中属于共价化合物的是( )
| A. | NH4Cl | B. | CuSO4 | C. | CO2 | D. | Br2 |
5.现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入稀硫酸溶液中,W发生还原反应;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z.根据上述情况判断正确的是( )
| A. | 在①中金属片Y发生还原反应 | |
| B. | 在②中金属片W作负极 | |
| C. | 上述四种金属的活动性顺序为W<X<Z<Y | |
| D. | 如果把Y、W用导线相连后同时浸入稀硫酸溶液,则电子流动方向为Y→导线→W |
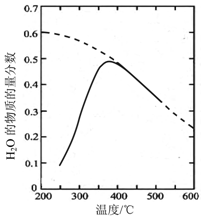 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应: