题目内容
7.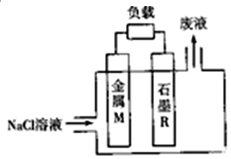 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )| A. | 电池工作时,电子沿M电极→电解质溶液→R电极流动 | |
| B. | 电池工作时,正极附近溶液的pH增大 | |
| C. | 在锌、铁、铝、锂中,锂的比能量最高 | |
| D. | 若M为锌时,电池反应为 Zn+2H2O═Zn(OH)2+H2↑ |
分析 依据原电池结构图可知,金属M为原电池负极,石墨R为原电池正极;
A.原电池电子移动方向:负极→负载→正极;
B.燃料电池中,正极氧气得到电子发生还原反应;
C.理论比能量:指1kg反应物质完全放电时所能输出的能量;
D.若M为锌,发生吸氧腐蚀,电池反应方程式为2Zn+2H2O+O2=2Zn(OH)2.
解答 解:A.原电池电子移动方向:负极→负载→正极,电解质溶液中不含电子,故A错误;
B.燃料电池中,正极氧气得到电子发生还原反应生成氢氧根离子,所以正极区pH值升高,故B正确;
C.锌、铁、铝、锂四种金属中,失去2mol电子,消耗的锂质量最小,所以锂的比能量最高,故C正确;
D.若M为锌,发生吸氧腐蚀,电池反应方程式为:2Zn+2H2O+O2=2Zn(OH)2,故D错误;
故选:BC.
点评 本题考查化学电源新型电池,侧重考查原电池原理,明确各个电极上发生的电极反应是解本题关键,会书写电极反应式,难度不大.

练习册系列答案
相关题目
13.下列叙述不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 大量排放SO2、NO2会导致酸雨的形成 | |
| C. | 废弃的金属、纸制品及玻璃都是可回收再利用的资源 | |
| D. | 纤维素可直接成为人的营养物质 |
15.研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
2.分子式为C6H14O且含有“-CH2OH”的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8 种 | C. | 9 种 | D. | 10种 |
12.下列关于有机物的叙述中
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥
⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥

⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
19.下列物质的分离方法的原理与溶解度不相关的是( )
| A. | 蒸馏分馏 | B. | 重结晶法 | C. | 纸层析法 | D. | 萃取分液 |
16. 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于由非极性键构成的极性分子 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同位素 |
17.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 1-己烯、苯 | C. | 苯、正已烷 | D. | 甲苯、2-己烯 |
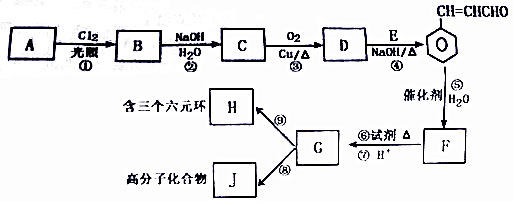
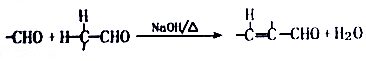
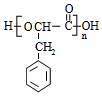 .
.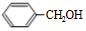 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2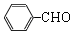 +H2O.
+H2O.