题目内容
20.工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同).下列说法中,不正确的是( )| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
分析 A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应;
C.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-;
D.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-在阴极上被还原,且溶液中还有Cr2O72-被还原.
解答 解:A.对比实验①②,这两个实验中只有溶液酸性强弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大,所以降低pH可以提高Cr2O72-的去除率,故A正确;
B.实验②中,Cr2O72-在阴极上得电子发生还原反应,电极反应式为Cr2O72-+6e-+14H+═2Cr3++7H2O,故B正确;
C.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,所以导致Cr2O72-去除率提高,故C正确;
D.实验③中,Cr2O72-在阴极上得电子,且溶液中的亚铁离子也能还原Cr2O72-,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-在阴极上被还原,且溶液中还有1molCr2O72-被Fe2+还原,所以一共有2 mol Cr2O72-被还原,故D错误;
故选D.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及电解原理是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,易错选项是D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 在12.0g NaHSO4晶体中,所含离子数目为0.3NA | |
| B. | 在1.0L 1.0mol/L的NaA1O2溶液中,含有的氧原子数为2NA | |
| C. | 将1molCl2通入足量水中,转移电子数为NA | |
| D. | 常温常压下,2.2gC O2和N2O的混合气体含有的电子数为1.1NA |
11.下列说法正确的是( )
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 铅蓄电池放电时的负极和充电时的阳极均发生在原反应 | |
| C. | 水解NH4++H2O?NH3•H2O+H+反应达到平衡后,升高温度平衡逆向移动 | |
| D. | 等体积、等物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
15.研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
5.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
(1)实验①中产生气泡的离子方程式为Fe+2H+═Fe2++H2↑.
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
[猜想假设]黑色粉末X的组成可能是Fe、Fe3O4,或二者的混合物.
[实验探究]
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+.
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如图所示实验:

请根据数据分析说明黑色粉末X中是否含有Fe3O4.方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4;
方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4.
12.下列关于有机物的叙述中
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥
⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥

⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
9.下列有关说法正确的是( )
| A. | NaOH是只含离子键的离子化合物 | |
| B. | HCl溶于水没有破坏共价键 | |
| C. | 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 | |
| D. | 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
10.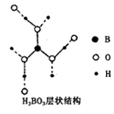 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$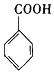
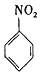 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$