题目内容
3. 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
水电解反应:2H2O(l) $\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)
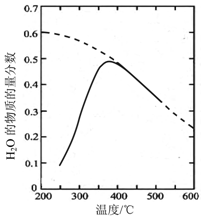
(1)将原料气按n(CO2):nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线).
①该反应的平衡常数K随温度升高而减小(填“增大”或“减小”).
②温度过高或过低均不利于该反应的进行,原因是温度过低,反应速率小;温度过高,反应向右进行的程度小.
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为$\frac{0.3P×(0.6P)^{2}}{0.02P×(0.08P)^{4}}$.(不必化简.用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是CE(填标号).
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)?C(s)+2H2O(g)代替Sabatier反应.
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ•mol-1、-242kJ•mol-1,Bosch反应的△H=-90kJ•mol-1.(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是反应的活化能高.
③新方案的优点是氢原子利用率为100%.
分析 (1)①根据图知,当反应达到平衡状态后,升高温度,水的物质的量分数减小,说明平衡逆向移动;
②温度过低,化学反应速率小;温度过高,平衡逆向移动;
③设开始时n(CO2)为1mol、n(H2)=4mol,
设参加反应的n(CO2)为xmol,
该反应方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)
开始(mol)1 4 0 0
反应(mol)x 4x x 2x
平衡(mol)1-x 4-4x x 2x
水蒸气的物质的量分数=$\frac{2x}{1-x+4-4x+x+2x}$=0.6,x=$\frac{15}{16}$
P(CO2)=P×$\frac{1-\frac{15}{16}}{5-2×\frac{15}{16}}$=0.02P、P(H2)=$\frac{4×(1-\frac{15}{16})}{5-2×\frac{15}{16}}$×P=0.08P、P(CH4)=$\frac{\frac{15}{16}}{5-2×\frac{15}{16}}$×P=0.3P、P(H2O)=$\frac{2×\frac{15}{16}}{2-5×\frac{15}{16}}$×P=0.6P,
压强平衡常数K=$\frac{P(C{H}_{4}).{P}^{2}({H}_{2}O)}{P(C{O}_{2}).{P}^{4}({H}_{2})}$;
(2)改变条件能使平衡正向移动但不能是通过增大二氧化碳浓度实现的都能提高二氧化碳转化率;
(3)①Bosch反应的△H等于水的生成焓的二倍减去二氧化碳的生成焓;
②该反应所需的活化能较高;
③该反应中氢元素完全转化为水.
解答 解:(1)①根据图知,当反应达到平衡状态后,升高温度,水的物质的量分数减小,说明平衡逆向移动,则生成物浓度减小、反应物浓度增大,所以化学平衡常数减小,故答案为:减小;
②温度过低,化学反应速率小;温度过高,平衡逆向移动,反应向右进行的程度减小,所以温度过高或过低均不利于该反应的进行,
故答案为:温度过低,反应速率小;温度过高,反应向右进行的程度小;
③设开始时n(CO2)为1mol、n(H2)=4mol,
设参加反应的n(CO2)为xmol,
该反应方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)
开始(mol)1 4 0 0
反应(mol)x 4x x 2x
平衡(mol)1-x 4-4x x 2x
水蒸气的物质的量分数=$\frac{2x}{1-x+4-4x+x+2x}$=0.6,x=$\frac{15}{16}$
P(CO2)=P×$\frac{1-\frac{15}{16}}{5-2×\frac{15}{16}}$=0.02P、P(H2)=$\frac{4×(1-\frac{15}{16})}{5-2×\frac{15}{16}}$×P=0.08P、P(CH4)=$\frac{\frac{15}{16}}{5-2×\frac{15}{16}}$×P=0.3P、P(H2O)=$\frac{2×\frac{15}{16}}{2-5×\frac{15}{16}}$×P=0.6P,
压强平衡常数K=$\frac{P(C{H}_{4}).{P}^{2}({H}_{2}O)}{P(C{O}_{2}).{P}^{4}({H}_{2})}$=$\frac{0.3P×(0.6P)^{2}}{0.02P×(0.08P)^{4}}$,
故答案为:$\frac{0.3P×(0.6P)^{2}}{0.02P×(0.08P)^{4}}$;
(2)A.适当减压,平衡逆向移动,二氧化碳转化率减小,故A错误;
B.增大催化剂的比表面积,催化剂不影响反应物的转化率,故B错误;
C.反应器前段加热,后段冷却,平衡正向移动,二氧化碳转化率增大,故C正确;
D.提高原料气中CO2所占比例,平衡正向移动,但二氧化碳转化率减小,故D错误;
E.合理控制反应器中气体的流速,相当于增大浓度,平衡正向移动,二氧化碳转化率增大,故E正确;
故选CE;
(3)①Bosch反应的△H=2(-242kJ•mol-1)-(-394kJ•mol-1)=-90kJ/mol,
故答案为:-90;
②断裂二氧化碳和氢气所需的能量较高,所以该反应所需的活化能较高,则一定条件下Bosch反应必须在高温下才能启动,故答案为:反应的活化能高;
③该反应中氢元素完全转化为水,氢原子利用率为100%,
故答案为:氢原子利用率为100%.
点评 本题考查化学平衡计算、化学平衡影响因素等知识点,为高频考点,侧重考查学生分析、判断及计算能力,注意:图2中200℃时水的物质的量分数是0.6而不是0.1,为易错点.

| A. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| D. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 |
| A. | 硬度一定很大 | B. | 熔沸点一定很高 | C. | 一定只含共价键 | D. | 可能含有离子键 |
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 铅蓄电池放电时的负极和充电时的阳极均发生在原反应 | |
| C. | 水解NH4++H2O?NH3•H2O+H+反应达到平衡后,升高温度平衡逆向移动 | |
| D. | 等体积、等物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |

| A. | 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 | |
| B. | ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 | |
| C. | ③中采用了牺牲阳极的阴极保护法保护桥墩 | |
| D. | ①②③中海水均是实现化学能与电能相互转化的电解质 |
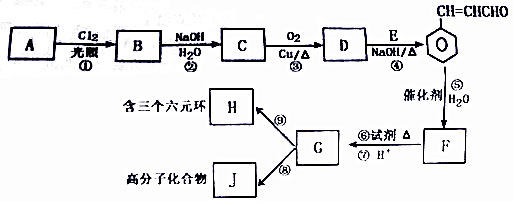
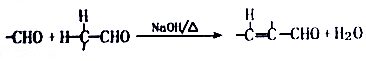
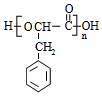 .
.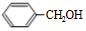 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2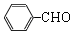 +H2O.
+H2O.
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$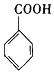
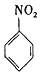 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$

 A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.
A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.