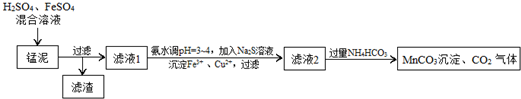
题目内容
12.阿伏加德罗常数的数值是6.02×1023,代表符号是NA,1mol任何物质都含有NA个基本单元.分析 12gC-12中含有的碳原子数称为阿伏伽德罗常数,符号为NA,将阿伏伽德罗常数个微粒看做一个整体,称为1mol,据此分析.
解答 解:12gC-12中含有的碳原子数称为阿伏伽德罗常数,而12gC-12中含有的碳原子数约为6.02×1023个,故阿伏伽德罗常数的数值为6.02×1023,单位为mol-1,符号为NA,将阿伏伽德罗常数个微粒看做一个整体,称为1mol,故1mol任何物质中均含有NA个微粒,即NA个基本单元,故答案为:6.02×1023;NA;NA;
点评 本题考查了阿伏伽德罗常数的数值和单位以及符号等基础问题,掌握基础并理解概念是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列叙述中,正确的是( )
| A. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料有机色素褪色 | |
| D. | 氯气可用于自来水消毒,因其反应产生次氯酸能杀死细菌 |
20.关于Na原子,下列选项中数值最大的是( )
| A. | 核内质子数 | B. | 核外电子数 | C. | 核外电子层数 | D. | 中子数 |
7.化学与生活密切相关,下列有关说法错误的是( )
| A. | 把抗氧化剂作为食品添加剂可减缓食物变质的速率 | |
| B. | 金属钾、钠、镁着火时,不能用泡沫灭火器灭火 | |
| C. | PM 2.5粉尘中常含Pb、Cd、Cr、V、As等对人体有害的金属元素 | |
| D. | 用激光笔分别照射装有蓝墨水、淀粉溶液的玻璃杯均出现光亮通路 |
17.下列说法正确的是( )
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
7.有机物分子式为C5H12O,且能与金属钠反应生成氢气,其可能的结构有多少种( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
4.下表是元素周期表的一部分:
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式填空:(不得用a~h字母回答)
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
(1)单质氧化性最强的是F2,金属性最强的是Na.
(2)最高价氧化物对应的水化物中,碱性最强的是NaOH、酸性最强的是HClO4.
(3)原子半径最大的元素是NaOH.
(4)f、g和h的气态氢化物的稳定性由强到弱的顺序是HF>HCl>PH3.
(5)b和c两者的最高价氧化物对应的水化物间反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,c和e两者的最高价氧化物对应的水化物间反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(6)在b、c、g、h中,离子半径最大的是Cl-.