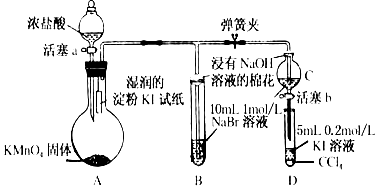
题目内容
18.在mA+nB=pC的反应中,(m、n、p为各物质的化学计量数)现测得C每分钟增加 2mol•L-1,B每分钟减少1.5mol•L-1,A每分钟减少0.5mol•L-1,则m:n:p为( )| A. | 4:3:1 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
分析 化学反应速率之比等于化学计量数之比,以此来解答.
解答 解:测得C每分钟增加 2mol•L-1,B每分钟减少1.5mol•L-1,A每分钟减少0.5mol•L-1,则A、B、C的速率之比为0.5:1.5:2=1:3:4,由化学反应速率之比等于化学计量数之比可知,则m:n:p为1:3:4,
故选C.
点评 本题考查反应速率与化学计量数,为高频考点,把握速率之比等于化学计量数之比为解答的关键,侧重分析与应用能力的考查,注意相同时间浓度变化量之比等于速率之比,题目难度不大.

练习册系列答案
相关题目
9.关于如图所示各装置的叙述中,正确的是( )
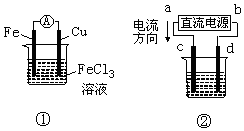

| A. | 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 装置①中,铁做负极,该电极反应式为:Fe3++e-═Fe2+ | |
| C. | 装置②为铁上镀铜装置c为纯铜电极 | |
| D. | 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
6.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,大量用作棉,麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
10.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
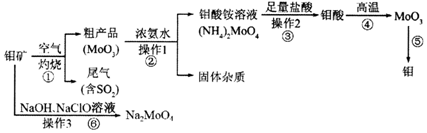
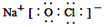 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O