题目内容
19.实验室中需要0.2mol•L-1的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取胆矾晶体(CuSO4•5H2O式量为250)的质量分别是( )| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
分析 依据配制溶液的体积依据“大而近”的原则选择合适的容量瓶;依据m=CVM计算需要溶质的质量.
解答 解:需要0.2mol•L-1的CuSO4溶液950mL,实验室没有950mL容量瓶,应选择1000mL容量瓶,实际配制1000mL溶液,需要溶质的质量m=0.2mol/L×1L×250g/mol=50.0g;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制和有关物质的量浓度计算,明确物质的量浓度含义及配制原理是解题关键,注意容量瓶规格选项的依据,题目难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
10.使用容量瓶配制溶液时,下列操作正确的是( )
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
7.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
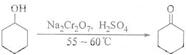
环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应.反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为缓慢滴加.
②蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的混合物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层.
(3)利用红外光谱图,可确定环己酮分子含官能团名称羰基.
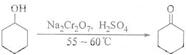
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多.实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应.反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物.
①酸性Na2Cr2O7溶液的加料方式为缓慢滴加.
②蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的混合物一起蒸出.
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水.
①上述操作的正确顺序是cdba(填字母).
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗.
③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层.
(3)利用红外光谱图,可确定环己酮分子含官能团名称羰基.
14.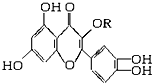 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
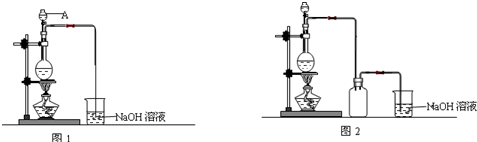
4.天津“8.12“爆炸中扩散的CN-造成部分水体污染.某小组欲检测污水中CN-的浓度并模拟电化学法除去CN-.
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN-+5H202+90H-═2CO32-+N2+6H20
实验装置如图1(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
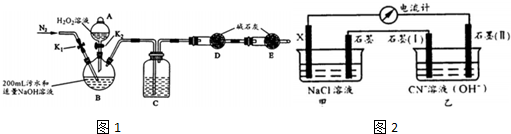
(1)加入药品之前的操作是检查装置气密性;C中试剂是浓H2S04
(2)实验步骤如下:
(3)计算CN-的浓度,需称得的质量是反应前后D装置的质量.
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量).
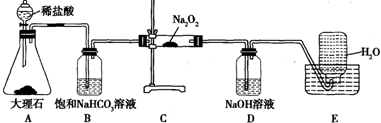
探究Ⅱ电化学法处理CN-的影响因素由如图2装置模拟电化学法实验,有关结果如表.
(5)根据表格信息分析.
①X电极名称:负极;
②实验(1)中X换成Zn,则电流计读数的范围为I~1.5I
③若乙装置中阳极产生无毒无害物质,其电极方程式为2CN-+12OH--10e-=2CO32-+N2+6H2O;该实验说明电化学法处理CN-,影响处理速率的因素有负极的金属材料和甲中电解质的浓度(至少两条).
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN-+5H202+90H-═2CO32-+N2+6H20
实验装置如图1(其中加热、夹持装置省略).(不考虑污水中其它离子反应)

(1)加入药品之前的操作是检查装置气密性;C中试剂是浓H2S04
(2)实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量).
探究Ⅱ电化学法处理CN-的影响因素由如图2装置模拟电化学法实验,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
①X电极名称:负极;
②实验(1)中X换成Zn,则电流计读数的范围为I~1.5I
③若乙装置中阳极产生无毒无害物质,其电极方程式为2CN-+12OH--10e-=2CO32-+N2+6H2O;该实验说明电化学法处理CN-,影响处理速率的因素有负极的金属材料和甲中电解质的浓度(至少两条).