��Ŀ����
11��������ʵһ����֤��HNO2��������ʵ��ǣ��������ٳ����� NaNO����Һ��pH����7
��HNO2���ȶ��������ֽ�
��HNO2��NaCI���ܷ�����Ӧ
�ܳ�����0.1mol•Lһ1HNO2��Һ��pH=2.1
�ݳ�����pH=3��HNO2��Һ��pH=11��NaOH��Һ�������ϣ�pHС��7
������pH=2��HNO2��Һϡ����100����pHԼΪ3.1��
| A�� | �٢ܢ� | B�� | �٢ڢܢݢ� | C�� | �٢ܢݢ� | D�� | ȫ�� |
���� ���ͨ�Բ���˵����ĵ���̶ȣ����������ȫ���������ˮ��Ĺ���������HNO2��������ʣ�
��� �⣺�ٳ���������������Һ��pH����7��˵����������Ϊǿ�������Σ�������˵��������Ϊ���ᣬ����ȷ��
��HNO2���ȶ��������ֽ⣬�ȶ��Բ������˵������ˮ�еĵ���̶ȣ���˵��HNO2��������ʣ��ʴ���
��HNO2��NaCl���ܷ�����Ӧ��ֻ��˵�������ϸ��ֽⷴӦ��������������˵�������ᣬ�ʴ���
�ܳ�����0.1 mol•L-1 HNO2��Һ��pH=2.1��˵���������ȫ���룬��Һ�д��ڵ���ƽ�⣬������˵��������Ϊ���ᣬ����ȷ��
�ݳ�����pH=3��HNO2��Һ��pH=11��NaOH��Һ�������ϣ�pHС��7��˵���������ȫ���룬��Һ�д��ڵ���ƽ�⣬������˵��������Ϊ���ᣬ����ȷ��
������pH=2��HNO2��Һϡ����100����pHԼΪ3.1˵���������д��ڵ���ƽ�⣬��������Ϊ������ʣ�����ȷ��
��ѡC��
���� ���⿼��������ʵ��жϣ���ȷ������ʵ������ǽ����Ĺؼ������õķ��������õ���IJ���ȫ�ԡ��ⶨ����Һ��pH�����Ա�ʵ������ж�������ʣ�

��ϰ��ϵ�д�
 һ����������ϵ�д�
һ����������ϵ�д�
�����Ŀ
19��ʵ��������Ҫ0.2mol•L-1��CuSO4��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡ�������壨CuSO4•5H2Oʽ��Ϊ250���������ֱ��ǣ�������
| A�� | 1000mL 50.0g | B�� | 950mL 47.5g | C�� | 950mL 30.4g | D�� | 1000mL 32.0g |
16��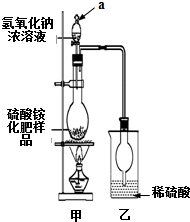 �������һ�ֳ��õ��̬���ʣ����ҹ涨�����������£�
�������һ�ֳ��õ��̬���ʣ����ҹ涨�����������£�
ij��ѧ�о���ѧϰС��ͬѧ�����ʵ����У���ijũ��Ʒ�̵���۵�һ��Ʒ����炙��ʵ�Ʒ�ʽ��м�⣮
[�۲����]������炙����ɼ���е���ʣ�
[ʵ����]
��1��ͨ��ʵ���Ҽ���ij��Ʒ�Ƿ�Ϊ��Σ��ǽ���Ʒ��B������ţ���ͬ�����ȣ�����C��E������������壮
A��ǿ�� B��ǿ��� C��ʪ��ĺ�ɫʯ����ֽD��ʪ�����ɫʯ����ֽ
E����պ��Ũ����IJ���������F����պ��Ũ����IJ�����
��2������ͼ��ʾװ�ý���ʵ�飮����a�������Ƿ�Һ©������ƿ�ڷ�����Ӧ�����ӷ���ʽΪ��NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
��3��ʵ������У�������ƿ�м�������Ũ����������Һ����ּ��ȣ�ԭ���ǣ�ʹ����麟�ַ�Ӧ��ȫת��ΪNH3����ȫ�������ձ��ң�
[��������]
��4��ijͬѧ���ݴ�ʵ���õ����ݣ���������炙��ʵĺ�����ƫ�ߣ���21.2%���������ʵ��װ���д���һ������ȱ���ǣ��ס���װ�ü�ȱһ������װ�ã�
[̽������]
��5���øĽ����ʵ��װ�����½���ʵ�飮��ȡ13.5g����炙�����Ʒ�����ʵ��ǰ����װ������3.40g���û��ʲ��ǣ���ǡ����ǡ���һ��Ʒ��
 �������һ�ֳ��õ��̬���ʣ����ҹ涨�����������£�
�������һ�ֳ��õ��̬���ʣ����ҹ涨�����������£�| ָ�� ��Ŀ | �ŵ�Ʒ | һ��Ʒ | �ϸ�Ʒ |
| �� �� | ��ɫ�ᾧ���ɼ���е���� | �ɼ���е���� | |
| ����N������ | ��21.0% | ��21.0% | ��20.5% |
[�۲����]������炙����ɼ���е���ʣ�
[ʵ����]
��1��ͨ��ʵ���Ҽ���ij��Ʒ�Ƿ�Ϊ��Σ��ǽ���Ʒ��B������ţ���ͬ�����ȣ�����C��E������������壮
A��ǿ�� B��ǿ��� C��ʪ��ĺ�ɫʯ����ֽD��ʪ�����ɫʯ����ֽ
E����պ��Ũ����IJ���������F����պ��Ũ����IJ�����
��2������ͼ��ʾװ�ý���ʵ�飮����a�������Ƿ�Һ©������ƿ�ڷ�����Ӧ�����ӷ���ʽΪ��NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��
��3��ʵ������У�������ƿ�м�������Ũ����������Һ����ּ��ȣ�ԭ���ǣ�ʹ����麟�ַ�Ӧ��ȫת��ΪNH3����ȫ�������ձ��ң�
[��������]
��4��ijͬѧ���ݴ�ʵ���õ����ݣ���������炙��ʵĺ�����ƫ�ߣ���21.2%���������ʵ��װ���д���һ������ȱ���ǣ��ס���װ�ü�ȱһ������װ�ã�
[̽������]
��5���øĽ����ʵ��װ�����½���ʵ�飮��ȡ13.5g����炙�����Ʒ�����ʵ��ǰ����װ������3.40g���û��ʲ��ǣ���ǡ����ǡ���һ��Ʒ��
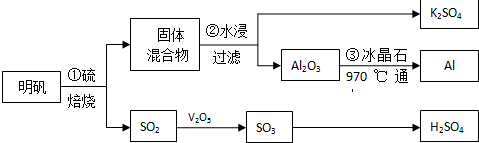
1���ڷ�Ӧ2KClO3�T2KCl+3O2���У�����1mol O2ת�Ƶ������ǣ�������
| A�� | 6NA | B�� | 12 NA | C�� | 2 NA | D�� | 4 NA |
 ��A�ĽṹʽH-C��C-H
��A�ĽṹʽH-C��C-H ��Ӧ���ͼӾ۷�Ӧ��F����B��ѧ����ʽHCl+CH2=CH2��CH3CH2Cl��
��Ӧ���ͼӾ۷�Ӧ��F����B��ѧ����ʽHCl+CH2=CH2��CH3CH2Cl��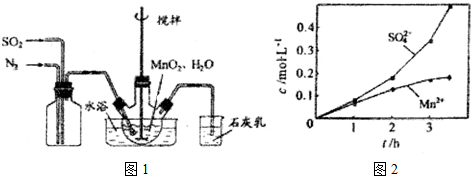

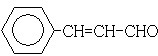 ��
�� ��
�� ��
�� ��
�� ��
�� �������������֣���
�������������֣���