题目内容
7.某有机物的核磁共振氢谱图如下,该有机物可能是( )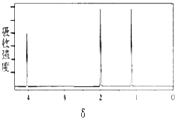
| A. | CH3-CH2-CH3 | B. | CH3CH2 CH2Br | C. | 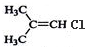 | D. | 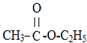 |
分析 根据核磁共振氢谱有几种吸收峰,故有机物分子中有几种H原子,峰的面积之比等于氢原子的个数之比,结合等效氢判断.
解答 解:核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,
A.CH3CH2CH3中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为3:1,故A错误;
B、CH3CH2 CH2Br中有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:2:2,故B错误,
C、 中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为6:1,故C错误;
中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为6:1,故C错误;
D、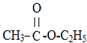 有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:3:2,故D正确;
有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:3:2,故D正确;
故选D.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数是解题的关键.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
18.用锌片与1mol•L-1稀盐酸反应制取氢气,下列措施不能使反应速率增大的是( )
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
15.今年入春以来,韩店雾霾天气频繁出现,空气质量很差,严重影响老百姓的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM25的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
2.用过量的锌与稀硫酸反应制H2时,下列能减缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量Na2CO3固体 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量NaOH固体 | D. | 加水 |
12.科学家预测,氨有望取代氢能,成为重要的新一代绿色能源.下列有关说法不正确的是( )
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
19.下列实验,能达到目的是( )
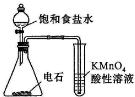

| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
16.在元素周期表这哪个区域寻找新的催化剂和制造耐高温、耐腐蚀的合金材料( )
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
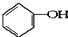 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$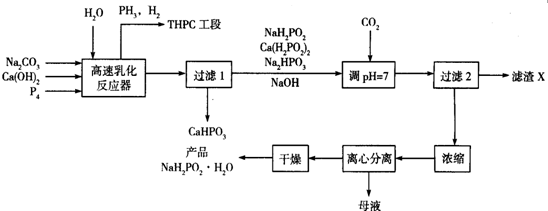
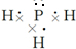 .
.