题目内容
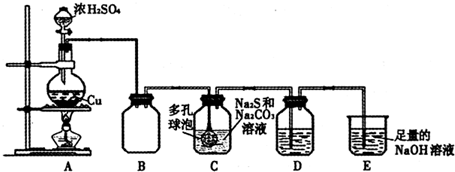
4.从海水中提取溴,主要反应为:2Br -+Cl2=Br2+2Cl-,下列说法正确的是( )| A. | 溴离子具有氧化性 | B. | 溴单质是氧化剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯元素的非金属性比溴元素强 |
分析 在氧化还原反应中得电子化合价降低的是氧化剂,失电子化合价升高的是还原剂,氧化剂具有氧化性,还原剂具有还原性,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,复分解反应是两种化合物相互交换成分生成另外的两种化合物,复分解反应一定不是氧化还原反应.
解答 解:A.该反应中溴离子失电子化合价升高,所以溴离子作还原剂,具有还原性,故A错误;
B.溴单质是氧化剂产物,故B错误;
C.该反应中有元素化合价的变化,属于氧化还原反应,复分解反应中反应前后各元素的化合价都不变,所以一定不属于复分解反应,故C错误;
D.根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,所以氯气的氧化性比溴单质强,所以氯元素的非金属性比溴元素强,故D正确;
故选D.
点评 本题考查了基本概念和基本理论,根据元素化合价的变化来分析解答即可,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
14.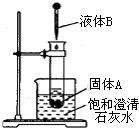 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
(1)试推测试剂A和B各是什么?(写出两组)
(2)解释烧杯中澄清石灰水变浑浊的原因:A与B反应放出热量,使烧杯中澄清的饱和石灰水温度升高,Ca(OH)2的溶解度随温度的升高而降低,因而析出Ca(OH)2沉淀,溶液变浑浊.
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:(1)试推测试剂A和B各是什么?(写出两组)
| 固体试剂A | 液体试剂B | |
| ① | ||
| ② |
15.今年入春以来,韩店雾霾天气频繁出现,空气质量很差,严重影响老百姓的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM25的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
12.科学家预测,氨有望取代氢能,成为重要的新一代绿色能源.下列有关说法不正确的是( )
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
19.下列实验,能达到目的是( )
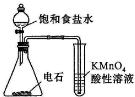

| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
9.下列有机物检验方法能达到实验目的是( )
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 除去乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液 | |
| C. | 用燃烧的方法鉴别甲烷与乙炔 | |
| D. | 用溴水鉴别苯和甲苯 |
16.在元素周期表这哪个区域寻找新的催化剂和制造耐高温、耐腐蚀的合金材料( )
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
13.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH3COONa中含有的共用电子对总数为8NA | |
| B. | 标准状况下,将22.4LCl2溶于水,反应转移电子数为NA | |
| C. | 450℃时,在催化剂的作用下,将2molSO2与一定量的O2混合反应,一段时间后测得SO2消耗了$\frac{1}{2}$,则该正反应消耗了NA个SO2分子 | |
| D. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA |