题目内容
 (1)图中所示反应是
(1)图中所示反应是(2)已知热化学方程式:H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能为
(3)1L1mol/L溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH反应的中和热的热化学方程式为
(4)向1L1mol/L的NaOH溶液中加入:①浓H2SO4;②稀硝酸; ③稀醋酸,
恰好完全反应的热效应△H1、△H2、△H3的大小关系为
(5)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
考点:反应热和焓变,用盖斯定律进行有关反应热的计算,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据图象分析,反应物能量高于生成物能量,依据能量守恒分析反应是放热反应,反应焓变△H=生成物总能量-反应物总能量=E2-E1;
(2)逆反应的活化能=正反应活化能-反应焓变得到;
(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(4)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热;
(5)根据化学平衡常数进行解答,平衡时生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代表达式.
(2)逆反应的活化能=正反应活化能-反应焓变得到;
(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(4)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热;
(5)根据化学平衡常数进行解答,平衡时生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代表达式.
解答:
解:(1)图象分析,反应物能量高于生成物能量,依据能量守恒分析反应是放热反应,反应的焓变△H=生成物总能量-反应物总能量=E2-E1;
故答案为:放热;(E2-E1)KJ/mol;
(2)已知热化学方程式:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能=正反应活化能-反应焓变=167.2KJ/mol-(-241.8KJ/mol)=409.0KJ/mol,
故答案为:409.0KJ/mol;
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1;
(5)化学平衡常数是用生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代表达式,反应①C(s)+CO2(g)?2CO(g)平衡常数K=
,
故答案为:K=
.
故答案为:放热;(E2-E1)KJ/mol;
(2)已知热化学方程式:H2(g)+
| 1 |
| 2 |
故答案为:409.0KJ/mol;
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
(4)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1;
(5)化学平衡常数是用生成物浓度幂之积比反应物浓度幂之积,固体和纯液体不代表达式,反应①C(s)+CO2(g)?2CO(g)平衡常数K=
| [CO]2 |
| [CO2] |
故答案为:K=
| [CO]2 |
| [CO2] |
点评:本题考查了放热反应的图象分析、据活化能求焓变、热化学方程式书写、中和热、平衡常数表达式书写,题目难度中等.

练习册系列答案
相关题目
某烃完全燃烧后,生成二氧化碳和水的物质的量之比为n:(n-1),此烃可能是( )
| A、烷烃 | B、单烯烃 |
| C、炔烃 | D、苯的同系物 |
常温下测得NaA盐溶液的PH值是10,有关盐NaA的说法正确的是( )
| A、强酸弱碱盐 |
| B、强碱弱酸盐 |
| C、强酸强碱盐 |
| D、弱酸弱碱盐 |
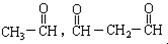 ,试写出该烃的结构简式.
,试写出该烃的结构简式.