题目内容
7.A、B、C、D都是短周期元素,原子半径:D>C>A>B;其中A、B处于同一周期,A、C 处于同一主族;C原子核内质子数等于A、B原子核内质子数之和,C原子最外层电子数是D原子最外层电子数的4倍.(1)这四种元素的元素符号分别是AC,BO,CSi,DNa;
(2)D单质在B单质中燃烧的化学方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)A、C的最高价含氧酸酸性强弱顺序是(填化学式):H2CO3>H2SiO3.
分析 根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: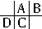 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧;因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠、C为硅、A为碳,据此进行解答.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧;因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠、C为硅、A为碳,据此进行解答.
解答 解:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: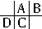 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C质子数等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D的4倍,则D最外层电子数只能为1,故D为钠,C为硅,A为碳,
(1)由上述分析可知,A、B、C、D的元素符号分别是C、O、Si、Na,
故答案为:C;O;Si;Na;
(2)D单质为金属钠,B单质为氧气,钠在氧气中燃烧生成过氧化钠,反应的化学方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)A为C、C为Si元素,非金属性:C>Si,则最高价氧化物对应水合物的酸性强弱为:H2CO3>H2SiO3,
故答案为:H2CO3>H2SiO3.
点评 本题考查元素位置结构性质的关系应用,题目难度中等,推断元素种类为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.精制蔗糖使之脱色,通常选用( )
| A. | SO2漂白 | B. | Cl2漂白 | C. | Na2O2漂白 | D. | 活性炭吸附 |
19.有下列3组有机物,①乙烯、苯、甲苯;②乙醇、乙酸、乙酸乙酯;③油脂、蛋白质、纤维素.根据你学过的知识,你认为下列说法错误的是( )
| A. | ①中有机物均可以发生还原反应 | |
| B. | ②中有机物可用饱和Na2CO3溶液鉴别 | |
| C. | ③中有机物均可以发生水解反应 | |
| D. | ③中有机物均属于高分子化合物 |
17.室温时,将V1mL c1 mol/L的NaOH溶液滴加到 V2mL c2 mol/L 的醋酸中,下述结论中正确的是( )
| A. | 若混合溶液的pH=7,则 c1V1>c2V2 | |
| B. | 若V1=V2、c1=c2,则混合溶液中 c(Na+)=c(Ac-) | |
| C. | 若V1=V2,且混合溶液的pH>7,则一定有 c1>c2 | |
| D. | 若混合溶液的pH=7,则混合溶液中 c(Na+)=c(Ac-) |
 ,电子式表示化合物 C2D 的形成过程
,电子式表示化合物 C2D 的形成过程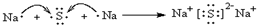 ;
; (1)分别取等物质的量的金属钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是1:2:3.
(1)分别取等物质的量的金属钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是1:2:3. 和
和 ,应选用a(填字母).
,应选用a(填字母).