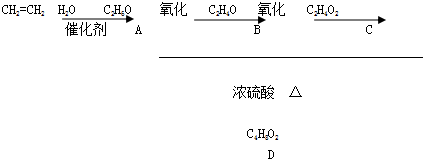
题目内容
16.具有明显现象的官能团特征反应常被用来鉴定化合物.①欲区分CH2=CH2和CH3CH3,应选用b(填字母).
a.NaOH溶液 b.溴水 c.银氨溶液
②欲区分HCHO和HCOOH,应选用c(填字母).
a.KMnO4溶液 b.银氨溶液 c.Na2CO3溶液
③欲区分
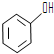 和
和 ,应选用a(填字母).
,应选用a(填字母).a.FeCl3溶液 b.NaOH溶液 c.AgNO3溶液.
分析 ①乙烯含碳碳双键,与溴水发生加成反应液,乙烷不能;
②HCOOH含-COOH,具有酸性,二者均含-CHO;
③分别为酚、醇,苯酚遇氯化铁显紫色.
解答 解:①乙烯含碳碳双键,与溴水发生加成反应液,乙烷不能,且二者均与NaOH溶液、银氨溶液不反应,则区分CH2=CH2和CH3CH3,应选用溴水,
故答案为:b;
②HCOOH含-COOH,具有酸性,二者均含-CHO,均能被高锰酸钾氧化,均可发生银镜反应,则区分HCHO和HCOOH,应选用Na2CO3溶液,
故答案为:c;
③分别为酚、醇,苯酚遇氯化铁显紫色,酚与NaOH的中和反应现象不明显,均与硝酸银不反应,则区分苯酚和苯甲醇,应选用FeCl3溶液,
故答案为:a.
点评 本题考查有机物的鉴别和检验,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列说法中不正确的是( )
| A. | 第三周期所包含的元素中钠的第一电离能最小 | |
| B. | 铝的第一电离能比镁的第一电离能小 | |
| C. | 在所有元素中,氟的电负性最大 | |
| D. | 钾的第一电离能比镁的第一电离能大 |
4.下列有关氧化还原反应的叙述中,正确的是( )
| A. | 氧化反应先于还原反应发生 | |
| B. | 一定有电子转移(得失或偏移) | |
| C. | 有单质生成或参加的反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
11.几种短周期元素的原子半径及主要化合价如表:
已知,X、Y、Z和M均为第三周期元素.下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化 合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | Y的非金属性大于S,其含氧酸酸性一定强于H2SO4 | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | X、Z、M的单质分别与水反应,M最剧烈 | |
| D. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
1.下列各烃中,完全燃烧时生成CO2与H2O的物质的量之比为2:1的是( )
| A. | C2H6 | B. | C2H4 | C. | CH4 | D. | C6H6 |
5.下列说法正确的是( )
| A. | 物质的量浓度均为0.1 mol•L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同 | |
| B. | 25℃时,在0.1 mol•L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7 | |
| C. | 25℃时,将0.1 mol•L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 | |
| D. | 将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |