题目内容
9.将16.8g小苏打固体加热,最多能产生标准状况下的二氧化碳多少升?分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,根据n=$\frac{m}{M}$计算16.8g NaHCO3的物质的量,根据方程式计算得到二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积.
解答 解:16.8g NaHCO3的物质的量为:$\frac{16.8g}{84g/mol}$=0.2mol,
设生成二氧化碳的物质的量为xmol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2 1
0.2mol x
则:x=$\frac{0.2mol×1}{2}$=0.1mol,
所以生成的二氧化碳在标准状况下的体积为:0.1mol×22.4L/mol=2.24L,
答:最多产生的二氧化碳在标准状况下的体积为2.24L.
点评 本题考查化学方程式的有关计算、常用化学计量有关计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握物质的量与气体摩尔体积、摩尔质量之间的关系,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是( )
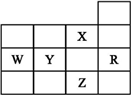

| A. | W元素气态氢化物较Y元素的气态氢化物稳定 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | X元素是非金属性最强的元素 |
17. 现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
 现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
现有mA(s)+nB(g)?pC(g)(正反应放热)的可逆反应,在一定温度下平衡时B的转化率和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )| A. | m+n<p | B. | n<p | ||
| C. | x点的混合物中v正<v逆 | D. | x点比y点的混合物正反应速度大 |
4.下列说法正确的是( )
| A. | 1 mo1•L-1NaCl溶液中含有1 mol Na+ | |
| B. | 1 mol O2的质量是32 g | |
| C. | 1 mol氢气的体积约为22.4 L | |
| D. | 标准状况下,11.2 L CH4含有10 mol电子 |
14.下列化学用语表述正确的是( )
| A. | CH3COOH在水中的电离方程式:CH3COOH+H2O=CH3COO-+H3O | |
| B. | 实验室制氯气的化学方程式:KClO3+6H37Cl(浓)=KCl+337Cl2↑+3H2O | |
| C. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH-$\frac{水浴}{加热}$CH3COO-+Cu2O↓+3H2O | |
| D. | 表示HCO3-水解的离子方程式为:HCO3-+H2O?CO32-+H3O |
1.下列反应适用于实验室制氢气的是:①锌与稀硫酸反应 ②甲烷受热分解 ③电解稀硫酸 ④赤热的炭与水蒸气反应( )
| A. | 只有① | B. | ①② | C. | ①③ | D. | ①②④ |
18.下列说法中不正确的是( )
| A. | 第三周期所包含的元素中钠的第一电离能最小 | |
| B. | 铝的第一电离能比镁的第一电离能小 | |
| C. | 在所有元素中,氟的电负性最大 | |
| D. | 钾的第一电离能比镁的第一电离能大 |
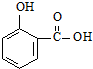 )的沸点与对羟基苯甲酸(
)的沸点与对羟基苯甲酸(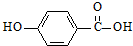 )的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.
)的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.