题目内容
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )①在标准状况下,1mol氦气含有的原子数为NA
②46gNO2和N2O4的混合物中含有的原子数为3NA
③标准状况下,5.6LCO2与足量Na2O2反应转移的电子数0.5NA
④0.5mol•L-1 Na2CO3溶液中含有的Na+数目为NA
⑤常温下,当7.1gCl2全部溶于水,反应中转移的电子数等于0.1NA
⑥标准状况下,1L CCl4所含分子数为$\frac{1}{22.4}$NA
⑦0.1molCl2与过量的铁反应转移电子数为0.2NA.
| A. | ①②③④⑤ | B. | ①②⑦ | C. | ②③⑤⑥ | D. | ①③⑤ |
分析 ①氦气为单原子分子;
②NO2和N2O4的最简式均为NO2;
③标准状况下,5.6LCO2的物质的量为0.25mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子;
④溶液体积不明确;
⑤氯气和水的反应为可可逆反应,不能进行彻底;
⑥标准状况下,CCl4为液态;
⑦Cl2与铁反应后氯元素变为-1价.
解答 解:①氦气为单原子分子,故1mol氦气中含NA个原子,故①正确;
②NO2和N2O4的最简式均为NO2,故46g混合物中含NO2的物质的量为n=$\frac{46g}{46g/mol}$=1mol,则含3mol原子即3NA个,故②正确;
③标准状况下,5.6LCO2的物质的量为0.25mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子,故0.25mol二氧化碳反应时,反应转移0.25mol电子即0.25NA个,故③错误;
④溶液体积不明确,故溶液中的钠离子的个数无法计算,故④错误;
⑤氯气和水的反应为可可逆反应,不能进行彻底,故反应转移的电子数小于0.1NA个,故⑤错误;
⑥标准状况下,CCl4为液态,故不能根据气体摩尔体积来计算其物质的量,故⑥错误;
⑦Cl2与铁反应后氯元素变为-1价,故0.1mol氯气反应后转移0.2mol电子即0.2NA个,故⑦正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.已知几种共价键能数据如下:
(1)通过计算,写出合成氨反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-90.8kJ/mol.
(2)某温度下,以0.1mol N2和0.4mol H2作为初始反应物,在体积为2L的恒容密闭容器中进行合成氨反应,5min后测得反应放热2270J.则此时容器中N2的物质的量浓度c(N2)=0.0375mol/L,用H2表示的化学反应速率v(H2)=0.0075mol•L-1min-1.
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
(2)某温度下,以0.1mol N2和0.4mol H2作为初始反应物,在体积为2L的恒容密闭容器中进行合成氨反应,5min后测得反应放热2270J.则此时容器中N2的物质的量浓度c(N2)=0.0375mol/L,用H2表示的化学反应速率v(H2)=0.0075mol•L-1min-1.
14.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )
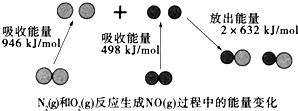

| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
11.想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类( )
①75%的酒精溶液 ②硝酸钠 ③碱石灰 ④豆浆.
①75%的酒精溶液 ②硝酸钠 ③碱石灰 ④豆浆.
| A. | ①④ | B. | ② | C. | ②③ | D. | ③④ |
8.常温下,不能证明HA是弱酸的是( )
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
15.常温时某溶液由水电离出c(H+)=a mol/L,c(OH-)=b mol/L,且a•b=1×10-28,该溶液中可能大量共存的离子是( )
①I-、Cl-、Ba2+、NO3-
②Na+、NO3-、K+、CO32-
③K+、SO42-、Na+、AlO2-
④HCO3-、NO3-、Al3+、SO42-.
①I-、Cl-、Ba2+、NO3-
②Na+、NO3-、K+、CO32-
③K+、SO42-、Na+、AlO2-
④HCO3-、NO3-、Al3+、SO42-.
| A. | 只有①④ | B. | 只有②③ | C. | ①②③ | D. | ①②③④都不能 |
13.下列说法中正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 2mol H2O 可以说为水分子的摩尔数为2mol | |
| C. | 物质的量是以摩尔为单位计量粒子数目的物理量 | |
| D. | 物质的量和摩尔都是含有一定数目粒子的集体 |