题目内容
18.能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
(1)氧化-还原法消除氮氧化物的转化:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
反应Ⅰ为:NO+O3═NO2+O2,生成11.2L O2(标准状况)时,转移电子的物质的量是1mol.反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1写出NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g)=2NO2(g),△H=-113.0kJ•mol-1.
(3)某化学兴趣小组构想将NO转化为HNO3,装置如图1,电极为多孔惰性材料.则负极的电极反应式是NO-3e-+2H2O=NO3-+4H+.
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);
该反应平衡常数表达式为K=$\frac{c(CH{\;}_{3}OCH{\;}_{3})×c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{2}(CO{\;}_{2})c{\;}^{6}(H{\;}_{2})}$.
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图2所示.该反应的△H<(填“大于”、“小于”或“等于”)0.
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)═CH3OH(g)△H<0.在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图3所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是Ⅲ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是T1.
分析 (1)根据化合价的变化来确定电子转移数目;反应方程式中,化学计量数之比等于物质的量之比;
(2)根据盖斯定律进行计算,书写热化学方程式;
(3)在原电池的负极上发生失电子的氧化反应;
(4)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;根据温度对平衡的影响分析△H的符号;
(5)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;
根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小.
解答 解:(1)NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5molO2(标准状况)时,转移电子的物质的量是1mol,当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的化学计量数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:1;6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,
由②-①×2得:2NO(g)+O2(g)=2NO2(g),△H=-196.6kJ•mol-1-2×(-41.8kJ•mol-1)=-113.0 kJ•mol-1,
故答案为:2NO(g)+O2(g)=2NO2(g),△H=-113.0 kJ•mol-1;
(3)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,
故答案为:NO-3e-+2H2O=NO3-+4H+;
(4)反应2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=$\frac{c(CH{\;}_{3}OCH{\;}_{3})×c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{2}(CO{\;}_{2})c{\;}^{6}(H{\;}_{2})}$,由图2可知:温度越高,CO2转化率越小,则平衡逆移,所以该反应正方向为放热反应,即△H<0,
故答案为:$\frac{c(CH{\;}_{3}OCH{\;}_{3})×c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{2}(CO{\;}_{2})c{\;}^{6}(H{\;}_{2})}$;<;
(5)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以CO转化率最大的反应温度是T1,
故答案为:Ⅲ;T1.
点评 本题考查的知识点较多,综合性较强,涉及氧化还原反应、化学方程式和电极反应式的书写、查盖斯定律的应用、平衡常数的计算、以及化学平衡的有关计算知识,难度较大.侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键.

 阅读快车系列答案
阅读快车系列答案| A. | 氧化剂和还原剂的物质的量比为8:3 | |
| B. | 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2:3 | |
| C. | 生成1molNO气体转移的电子数为3NA | |
| D. | 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物 |
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 碱性:NaOH>LiOH | D. | 热稳定性:HF>HBr |
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.(1)写出该反应的热化学方程式生成1mol H2O(l)时的反应热为-57.3kJ•mol-1$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表所示.
| 温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②上述实验数值结果与-57.3kJ•mol-1有偏差,产生偏差的原因不可能是(填字母)b.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1 的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3;.
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
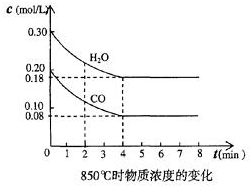
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
