题目内容
15.常温时某溶液由水电离出c(H+)=a mol/L,c(OH-)=b mol/L,且a•b=1×10-28,该溶液中可能大量共存的离子是( )①I-、Cl-、Ba2+、NO3-
②Na+、NO3-、K+、CO32-
③K+、SO42-、Na+、AlO2-
④HCO3-、NO3-、Al3+、SO42-.
| A. | 只有①④ | B. | 只有②③ | C. | ①②③ | D. | ①②③④都不能 |
分析 常温由水电离出c(H+)=a mol/L,c(OH-)=b mol/L,且a•b=1×10-28,则水的电离受到抑制,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:常温由水电离出c(H+)=a mol/L,c(OH-)=b mol/L,且a•b=1×10-28,则水的电离受到抑制,为酸或碱溶液,
①酸溶液中I-、NO3-发生氧化还原反应,碱溶液中该组离子之间不反应,可能大量共存,
②酸溶液中不能大量存在CO32-,碱溶液中该组离子之间不反应,可能大量共存,
③酸溶液中不能大量存在AlO2-,碱溶液中该组离子之间不反应,可能大量共存,
④酸碱溶液中均不能大量存在HCO3-,碱溶液中不能大量存在Al3+,一定不能共存,
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
6.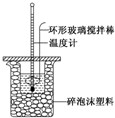 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
(1)写出该反应的热化学方程式生成1mol H2O(l)时的反应热为-57.3kJ•mol-1$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表所示.
①近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液的密度都是1.0g•mL-1,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则生成1mol H2O(l)时的反应热△H=-53.5kJ/mol(取小数点后一位).
②上述实验数值结果与-57.3kJ•mol-1有偏差,产生偏差的原因不可能是(填字母)b.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1 的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3;.
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.(1)写出该反应的热化学方程式生成1mol H2O(l)时的反应热为-57.3kJ•mol-1$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表所示.
| 温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②上述实验数值结果与-57.3kJ•mol-1有偏差,产生偏差的原因不可能是(填字母)b.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1 的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3;.
10.下列实验不能达到实验目的是( )
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
20.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. |  中和滴定 | ||
| C. |  测定中和反应的反应热 | D. |  构成铜锌原电池 |
5.某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下

实验过程中所用的物质x,y及pH控制参照下表确定:表I
表Ⅱ
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.

实验过程中所用的物质x,y及pH控制参照下表确定:表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | E | 氨水 |
| B | 高锰酸钾 | F | 碱式碳酸铜 |
| C | 氯水 | G | 氧化铜 |
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.
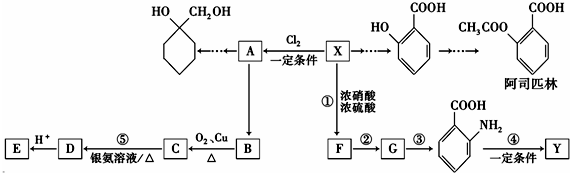
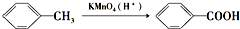
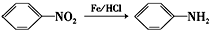 (苯胺,易被氧化)
(苯胺,易被氧化)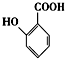 的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基;
的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O;
+(n-1)H2O;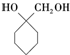 的合成路线(无机试剂任用).合成路线流程图示例如下:
的合成路线(无机试剂任用).合成路线流程图示例如下: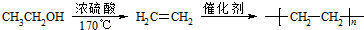
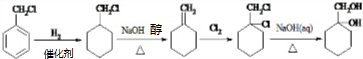 .
.