题目内容
14.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )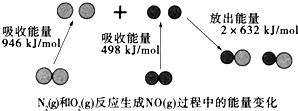
| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
分析 A、△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量;
B、由A可知,1mol N2(g)和NA个O2(g)反应生成2mol NO(g)时,吸收的能量为180kJ;
C、反应物的总能量小于生成物的总能量为吸热反应;
D、通常情况下,N2(g)和O2(g)不能发生化学反应.
解答 解:A、△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2(g)+O2(g)═2NO(g),△H=946KJ/mol+498KJ/mol-2×632KJ/mol=+180kJ/mol,故A正确;
B、由A可知,1mol N2(g)和NA个O2(g)反应生成2mol NO(g)时,吸收的能量为180kJ,故B错误;
C、N2(g)+O2(g)═2NO(g),△H=+180kJ/mol,为吸热反应,所以1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量,故C正确;
D、通常情况下,N2(g)和O2(g)不能发生化学反应,故D正确;
故选B.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
相关题目
2.下列各组物质只用胶头滴管和试管就能鉴别的是( )
| A. | KOH溶液与AlCl3溶液 | B. | AlCl3溶液与氨水 | ||
| C. | NaAlO2溶液与盐酸 | D. | NaHCO3溶液与盐酸 |
9.下列事实不能用元素周期律解释的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 碱性:NaOH>LiOH | D. | 热稳定性:HF>HBr |
19.下列说法错误的是( )
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
6.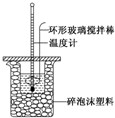 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
(1)写出该反应的热化学方程式生成1mol H2O(l)时的反应热为-57.3kJ•mol-1$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表所示.
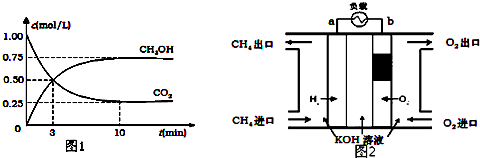
①近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液的密度都是1.0g•mL-1,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则生成1mol H2O(l)时的反应热△H=-53.5kJ/mol(取小数点后一位).
②上述实验数值结果与-57.3kJ•mol-1有偏差,产生偏差的原因不可能是(填字母)b.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1 的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3;.
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液进行反应热的测定,实验装置如图所示.(1)写出该反应的热化学方程式生成1mol H2O(l)时的反应热为-57.3kJ•mol-1$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表所示.
| 温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②上述实验数值结果与-57.3kJ•mol-1有偏差,产生偏差的原因不可能是(填字母)b.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)若将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1 的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3;.
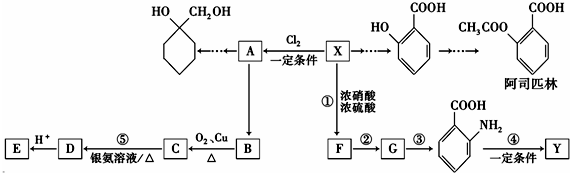
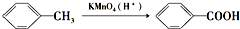
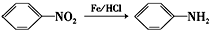 (苯胺,易被氧化)
(苯胺,易被氧化)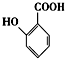 的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基;
的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O;
+(n-1)H2O;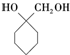 的合成路线(无机试剂任用).合成路线流程图示例如下:
的合成路线(无机试剂任用).合成路线流程图示例如下: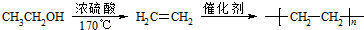
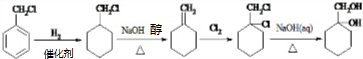 .
.