题目内容
13.下列说法中正确的是( )| A. | 物质的量就是物质的质量 | |
| B. | 2mol H2O 可以说为水分子的摩尔数为2mol | |
| C. | 物质的量是以摩尔为单位计量粒子数目的物理量 | |
| D. | 物质的量和摩尔都是含有一定数目粒子的集体 |
分析 A、物质的量是七个基本物理量之一;
B、水是由水分子构成的;
C、物质的量是用于描述微粒个数集合体的一个物理量;
D、物质的量是表示微观粒子集合体的物理量;
解答 解:A、物质的量是七个基本物理量之一,不是物质的质量,故A错误;
B、水是由水分子构成的,故2mol水即水分子的摩尔数为2mol,故B正确;
C、物质的量是用于描述微粒个数集合体的一个物理量,不是计量粒子数目,故C错误;
D、物质的量是表示微观粒子集合体的物理量,物质的量是含有一定数目粒子的集合体,摩尔是其单位,故D错误;
故选B.
点评 本题考查了物质的量、摩尔、质量等概念的分析判断,掌握概念实质是关键,题目较简单.

练习册系列答案
相关题目
1.下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)⑥的最低负价是-2;⑦的最高价含氧酸的化学式为HClO4.
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为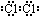 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为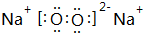 .
.
(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为
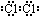 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为 .
.(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
8. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
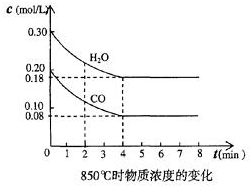
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
18.不能用胶体的知识解释的现象是( )
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 静电除尘 | |
| C. | 在海水与河水交界处,易形成三角洲 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
5.某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下

实验过程中所用的物质x,y及pH控制参照下表确定:表I
表Ⅱ
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.

实验过程中所用的物质x,y及pH控制参照下表确定:表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | E | 氨水 |
| B | 高锰酸钾 | F | 碱式碳酸铜 |
| C | 氯水 | G | 氧化铜 |
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
3.用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A. | 常温常压下,16gO2所含的原子数NA | |
| B. | 标准状况下,2.24L水所含的电子数为10NA | |
| C. | 2.4g金属镁与足量盐酸反应失去电子数0.2NA | |
| D. | 1.6g甲烷含有共用电子对数目0.4NA |
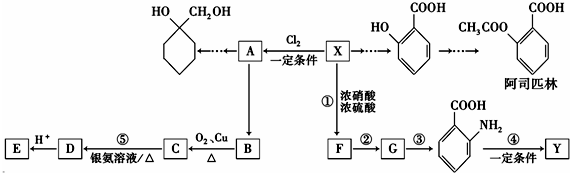
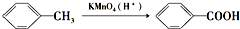
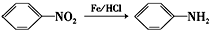 (苯胺,易被氧化)
(苯胺,易被氧化)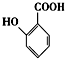 的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基;
的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O;
+(n-1)H2O;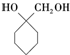 的合成路线(无机试剂任用).合成路线流程图示例如下:
的合成路线(无机试剂任用).合成路线流程图示例如下: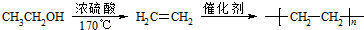
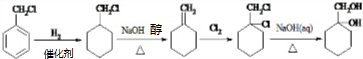 .
.