题目内容
下列叙述正确的是( )
| A、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、HClO见光会分解,故氯水保存在棕色试剂瓶中 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
考点:硝酸的化学性质,氯、溴、碘及其化合物的综合应用,钠的化学性质,铁的化学性质
专题:元素及其化合物
分析:A.常温下,Fe和浓HNO3发生钝化现象;
B.钠性质很活泼,投入盐溶液中先和水反应生成NaOH,NaOH再和部分盐发生复分解反应;
C.HClO见光会分解,所以氯水要避光保存;
D.铁属于变价金属,和氯气反应生成FeCl3,和弱氧化性气体反应生成+2价铁的化合物.
B.钠性质很活泼,投入盐溶液中先和水反应生成NaOH,NaOH再和部分盐发生复分解反应;
C.HClO见光会分解,所以氯水要避光保存;
D.铁属于变价金属,和氯气反应生成FeCl3,和弱氧化性气体反应生成+2价铁的化合物.
解答:
解:A.常温下,Fe和浓HNO3发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以不会产生大量红棕色气体,故A错误;
B.钠性质很活泼,投入盐溶液中先和水反应生成NaOH,NaOH再和部分盐发生复分解反应,所以将Na投入MgCl2溶液不能置换出Mg,钠和水生成的NaOH再和氯化镁发生复分解反应生成Mg(OH)2沉淀,故B错误;
C.HClO见光会分解,则氯水要避光保存,故氯水保存在棕色试剂瓶中,故C正确;
D.铁属于变价金属,和氯气反应生成FeCl3,和硫蒸气反应生成FeS,故D错误;
故选C.
B.钠性质很活泼,投入盐溶液中先和水反应生成NaOH,NaOH再和部分盐发生复分解反应,所以将Na投入MgCl2溶液不能置换出Mg,钠和水生成的NaOH再和氯化镁发生复分解反应生成Mg(OH)2沉淀,故B错误;
C.HClO见光会分解,则氯水要避光保存,故氯水保存在棕色试剂瓶中,故C正确;
D.铁属于变价金属,和氯气反应生成FeCl3,和硫蒸气反应生成FeS,故D错误;
故选C.
点评:本题考查金属、非金属的性质,涉及Fe、Na、HClO等知识点,注意钠和盐反应反应特点及现象,注意变价金属发生的氧化还原反应,易错选项是B.

练习册系列答案
相关题目
微量元素是指含量在人体总重量的0.01%以下的元素,这些元素对人体的正常发育和健康起着主要作用,下列各组元素全部是微量元素的是( )
| A、Na、K、Cl、S、O |
| B、N、H、O、P、C |
| C、F、I、Fe、Zn、Cu |
| D、Ge、Se、Cu、Mg、C |
下列叙述正确的是( )
A、乙酸的键线式是 |
B、间二甲苯 又叫2,4-二甲苯 又叫2,4-二甲苯 |
C、 的最长碳链有7个C原子 的最长碳链有7个C原子 |
D、 的名字读作:3位甲基3丁烯 的名字读作:3位甲基3丁烯 |
下列物质是电解质的为( )
| A、氨气 | B、硫酸钡 |
| C、水玻璃 | D、硝酸钾溶液 |
用于飞机制造的重要材料是( )
| A、Mg-Al合金 |
| B、Cu-Sn合金 |
| C、Fe-Si合金 |
| D、不锈钢 |
 据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、0.12g石墨烯中含有6.02×1022个碳原子 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
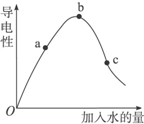 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题: 已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题:
已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题: