题目内容
下列关于铜电极的叙述正确的是( )
| A、铜锌原电池中铜是阳极 |
| B、用电解法精炼粗铜时纯铜作阳极 |
| C、在镀件上电镀铜时可用金属铜作阳极 |
| D、氯碱工业中用铜作阳极 |
考点:原电池和电解池的工作原理
专题:
分析:A.原电池中活泼金属作负极;
B.粗铜精炼时粗铜作阳极;
C.电镀Cu时Cu作阳极;
D.电解食盐水用惰性电极作阳极.
B.粗铜精炼时粗铜作阳极;
C.电镀Cu时Cu作阳极;
D.电解食盐水用惰性电极作阳极.
解答:
解:A.原电池中活泼金属作负极,铜锌原电池中,Zn活泼,则Zn为负极,Cu为正极,故A错误;
B.粗铜精炼时粗铜作阳极,纯铜作阴极,故B错误;
C.电镀Cu时Cu作阳极,在镀件上铜离子得到电子生成Cu,故C正确;
D.电解食盐水用惰性电极作阳极,若利用Cu为阳极,则生成氢氧化铜沉淀,故D错误;
故选C.
B.粗铜精炼时粗铜作阳极,纯铜作阴极,故B错误;
C.电镀Cu时Cu作阳极,在镀件上铜离子得到电子生成Cu,故C正确;
D.电解食盐水用惰性电极作阳极,若利用Cu为阳极,则生成氢氧化铜沉淀,故D错误;
故选C.
点评:本题考查原电池和电解原理的应用,明确粗铜精炼、电镀、电解食盐水等电解的应用是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用于飞机制造的重要材料是( )
| A、Mg-Al合金 |
| B、Cu-Sn合金 |
| C、Fe-Si合金 |
| D、不锈钢 |
下列有关氯水的表述不正确的是( )
| A、向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 |
| B、氯水中含有7种微粒,其可以与AgNO3、FeBr2等多种物质反应 |
| C、蓝色石蕊试纸放入氯水中先变红后褪色 |
| D、氯水可以导电,说明氯气是电解质 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、c(H+)=1.0×10-13mol/L溶液中:CH3COO-、K+、SO42-、Br- |
| C、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| D、pH=12的溶液中:NO3-、I-、Na+、Al3+ |
下列有关金属腐蚀与防护的说法正确的是( )
| A、当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用 |
| B、纯银器表面在空气中渐渐变暗是因为发生了化学腐蚀 |
| C、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
 据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、0.12g石墨烯中含有6.02×1022个碳原子 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
如图所示与对应的叙述相符的是( )
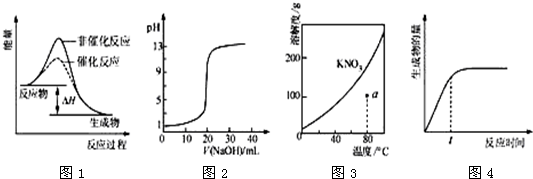

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
下列各组粒子中,互为同位素的是( )
| A、12H 13H |
| B、O2 O3 |
| C、红磷 白磷 |
| D、57La 58Ce |
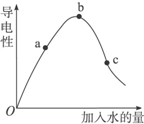 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题: