题目内容
5.如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放反应的化学方程式为 2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极上有红色物质析出,下列说法正确的是( )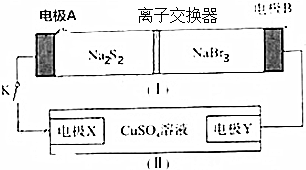
| A. | 装置①中钠离子从右到左通过离子交换膜 | |
| B. | B极的电极反应式为NaBr3+2e-+2Na═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1mol Na+通过离子交换膜,X电极上析出固体物质0.64g |
分析 当闭合开关K时,X极上有红色物质析出,说明X极生成Cu,则X为电解池的阴极,发生反应为Cu2++2e-=Cu,则A为原电池的负极,B为原电池的正极,根据电池充、放电的化学反应方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr可知,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为NaBr3+2Na++2e-=3NaBr,Y极为电解池的阳极,以此解答该题.
解答 解:A.装置(Ⅰ)为原电池,Na+向正极移动,A为原电池的负极,B为原电池的正极,因此Na+从左到右通过离子交换膜,故A错误;
B.B为原电池的正极,发生还原反应,反应为NaBr3+2Na++2e-=3NaBr,故B正确;
C.X为电解池的阴极,铜离子在阴极得电子生成Cu,即发生反应为Cu2++2e-=Cu,故C错误;
D.闭合K时,有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,阴极上生成0.05molCu,即生成0.05mol×64g/mol=3.2g,故D错误.
故选B.
点评 本题考查化学电源知识,侧重于学生的分析能力的考查,题目难度中等,注意从总反应式判断两极上的变化和电极反应式的书写.

练习册系列答案
相关题目
15.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
16.如图为某同学进行浓硫酸稀释的示意图,其中错误之处有( )


| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
13.在恒温恒容的密闭容器中加入1molX和2molY,发生如下反应:X(g)+2Y(g)?2Z(g),该反应达到平衡的标志是( )
| A. | 混合气体的密度不再随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为:1:2:2 | |
| C. | 单位时间消耗0.1molX,同时生成0.2molY | |
| D. | 单位时间消耗0.1molX,同时生成0.2molZ |
17.下列物质的性质比较正确的是( )
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
14.同温同压下两个体积相同的容器,一个盛NH3气体,另一个盛N2和H2的混合气体,两瓶气体一定有相同的是( )
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
15.空气负离子[O2-(H2O)n]-对人体健康有着重要的生理意义,被誉为“空气维生素”,人吸入一定量的空气负离子,会减少某些疾病的发生.而“空调综合征”与室内缺少空气负离子有关.下列有关空气负离子的说法不正确的是( )
| A. | 具有很强的生物活性 | B. | 是一种十分稳定的化合物 | ||
| C. | 能增强人体抗病能力 | D. | 具有除尘、除臭和杀菌等作用 |
 、
、 .
. .
. 、
、 .
. 、
、
 +
+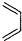 $\stackrel{△}{→}$
$\stackrel{△}{→}$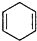 ,如果要合成
,如果要合成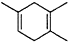 所用的原始原料可以是AC
所用的原始原料可以是AC